Bạn có bao giờ thắc mắc tại sao cục pin nhỏ xíu lại có thể thắp sáng cả chiếc đèn pin, hay đơn giản là vì sao miếng sắt để ngoài trời lại bị gỉ sét không? Đằng sau những hiện tượng quen thuộc ấy, và hàng tỷ phản ứng hóa học khác đang diễn ra quanh ta, là một cặp đôi quyền lực: tính khử và tính oxi hóa. Hôm nay, chúng ta sẽ cùng "giải mã" một nửa của cặp đôi này – tính khử. Tưởng tượng thế này nhé, tính khử chính là "khả năng cho đi" electron của một chất. Cứ có kẻ cho thì ắt có người nhận electron, đó chính là tính oxi hóa. Hai quá trình này luôn song hành, tạo nên "vũ điệu" electron đầy hấp dẫn trong hóa học. Từ việc tạo ra năng lượng trong pin, xử lý nước thải, cho đến quá trình luyện kim để có kim loại dùng hàng ngày, phản ứng "cho – nhận" electron này xuất hiện khắp mọi nơi. Vậy làm thế nào để nhận biết chất nào có tính khử, chất nào có tính oxi hóa? Và điều gì quyết định chất nào "mạnh" hơn trong việc cho đi electron?
Tính Khử Tính Oxi Hóa Và Phản Ứng Trung Tâm Của Hóa Học
Trong thế giới hóa học đầy màu sắc và biến đổi, có những khái niệm nền tảng mà nếu không nắm vững, ta sẽ khó lòng hiểu được muôn vàn phản ứng phức tạp. Tính khử và tính oxi hóa chính là cặp bài trùng như thế, chúng là trái tim của rất nhiều quá trình hóa học diễn ra xung quanh chúng ta, từ những gì nhỏ bé nhất trong cơ thể sống đến những phản ứng công nghiệp quy mô lớn.

Vậy, tính khử là gì? Nói một cách đơn giản nhất, tính khử là khả năng "nhường" đi các electron quý giá của mình. Hãy tưởng tượng electron như những món đồ mà một nguyên tử hay phân tử sẵn sàng cho đi. Chất nào càng dễ dàng "phóng thích" electron thì tính khử của nó càng mạnh.
Ngược lại, tính oxi hóa lại là "người" thích "nhận" electron. Chất nào có khả năng "thu hút" hay "cướp" electron từ kẻ khác thì chất đó mang tính oxi hóa. Khả năng này càng lớn thì tính oxi hóa càng mạnh.
Giờ thì đến lượt "nhân vật" chính trong phản ứng. Chất nào thể hiện tính khử, tức là nhường electron, ta gọi đó là chất khử. Điều thú vị là khi chất khử nhường electron, bản thân nó lại bị "oxi hóa". Ngược lại, chất nào thể hiện tính oxi hóa, tức là nhận electron, ta gọi đó là chất oxi hóa. Khi chất oxi hóa nhận electron, bản thân nó lại bị "khử". Nghe hơi lằng nhằng phải không? Cứ nhớ: chất khử thì bị oxi hóa, chất oxi hóa thì bị khử.
Khi tính khử và tính oxi hóa gặp nhau trong một "cuộc chơi" trao đổi electron, chúng ta có phản ứng oxi hóa khử. Đây là một loại phản ứng hóa học mà trong đó có sự chuyển dịch electron từ chất này sang chất khác.
Điều quan trọng nhất cần nhớ: quá trình nhường electron (oxi hóa) và quá trình nhận electron (khử) luôn diễn ra đồng thời trong cùng một phản ứng. Không có chuyện một chất tự nhiên nhường electron mà không có ai đó sẵn sàng nhận lấy, và cũng không có chuyện một chất tự nhiên nhận electron nếu không có ai đó "cho" đi. Chúng luôn đi đôi với nhau, như hai mặt của cùng một đồng xu, tạo nên sự cân bằng electron trong phản ứng. Phản ứng oxi hóa khử chính là "vũ điệu" trao đổi electron đầy sôi động này.
Bí Quyết Tìm Chất Khử Chất Oxi Hóa
Làm sao để biết ai là "người hùng" nhường electron, ai là "kẻ phản diện" nhận electron trong một phản ứng hóa học? Đừng lo, có những mẹo cực hay giúp bạn "chỉ mặt đặt tên" chất khử và chất oxi hóa nhanh như chớp đấy!
Công cụ "xịn sò" nhất giúp chúng ta làm điều này chính là "số oxi hóa". Cứ theo dõi sát sao "biến động" của con số này trên đầu mỗi nguyên tố trước và sau phản ứng là ra hết.
Nhớ kỹ nha: số oxi hóa tăng là dấu hiệu của chất khử (nó vừa bị oxi hóa đấy); còn số oxi hóa giảm thì đích thị là chất oxi hóa (nó vừa bị khử xong).
Tại sao lại thế? Đơn giản thôi, số oxi hóa tăng nghĩa là nguyên tử đó đã "cho đi" electron (vì electron mang điện tích âm mà). Chất nhường electron chính là chất khử. Ngược lại, số oxi hóa giảm tức là nguyên tử đó đã "nhận về" electron. Chất nhận electron chính là chất oxi hóa.
Cùng xem vài ví dụ cho dễ hình dung nhé:
Phản ứng quen thuộc giữa Natri và Clo tạo ra muối ăn:
2Na + Cl₂ -> 2NaCl
Trước phản ứng: Natri (Na) đứng một mình, số oxi hóa là 0. Clo (Cl₂) cũng vậy, số oxi hóa của mỗi nguyên tử Cl là 0.
Sau phản ứng: Trong NaCl, Natri có số oxi hóa +1, còn Clo có số oxi hóa -1.
Thấy Na từ 0 "nhảy vọt" lên +1 không? Số oxi hóa tăng! Nó đã "nhường" electron đấy, nên Na chính là chất khử.
Còn Cl₂ thì từ 0 "tụt dốc" xuống -1. Số oxi hóa giảm! Nó đã "nhận" electron, vậy Cl₂ là chất oxi hóa.
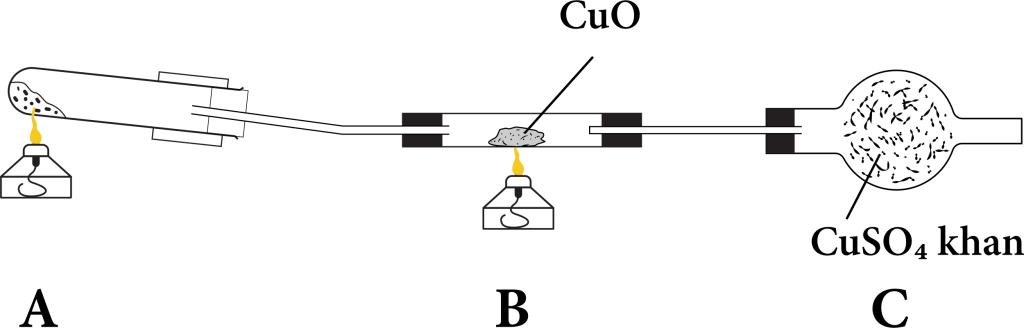
Một ví dụ khác phức tạp hơn chút: Đồng(II) oxit phản ứng với khí Hiđro:
CuO + H₂ -> Cu + H₂O
Trước phản ứng: Trong CuO, Cu có số oxi hóa +2, O là -2. H₂ đứng một mình, số oxi hóa là 0.
Sau phản ứng: Cu đứng một mình, số oxi hóa là 0. Trong H₂O, H là +1, O là -2.
Trong phản ứng này, Cu trong CuO từ +2 "rớt" xuống 0. Số oxi hóa giảm! CuO đã nhận electron, nên CuO là chất oxi hóa.
Còn H₂ từ 0 "nhảy" lên +1 (trong H₂O). Số oxi hóa tăng! H₂ đã nhường electron, nên H₂ là chất khử. Lưu ý là số oxi hóa của Oxi không thay đổi (-2) trong suốt phản ứng này.
Vậy đó, cứ theo dõi sát sao "biến động" của số oxi hóa là bạn sẽ "tóm gọn" được ngay ai là chất khử, ai là chất oxi hóa thôi. Nhớ nhé, chất khử là "kẻ" bị oxi hóa (số oxi hóa tăng), còn chất oxi hóa là "kẻ" bị khử (số oxi hóa giảm). Đơn giản phải không nào?
Độ Mạnh Tính Khử Vì Sao Khác Biệt
Không phải chất khử nào cũng có "sức mạnh" như nhau trong việc cho đi electron. Có những chất "hào phóng" cực kỳ, sẵn sàng nhả electron ngay lập tức, trong khi những chất khác lại "kín đáo" hơn nhiều. Sự khác biệt này đến từ cấu tạo nguyên tử và các yếu tố đặc trưng của chúng.
Yếu Tố Quyết Định Sức Mạnh
"Sức mạnh" của tính khử, hay khả năng nhường electron, phụ thuộc chủ yếu vào mức độ dễ dàng mà nguyên tử hay ion đó "buông tay" các electron hóa trị của mình. Ba yếu tố chính thường được nhắc đến là:
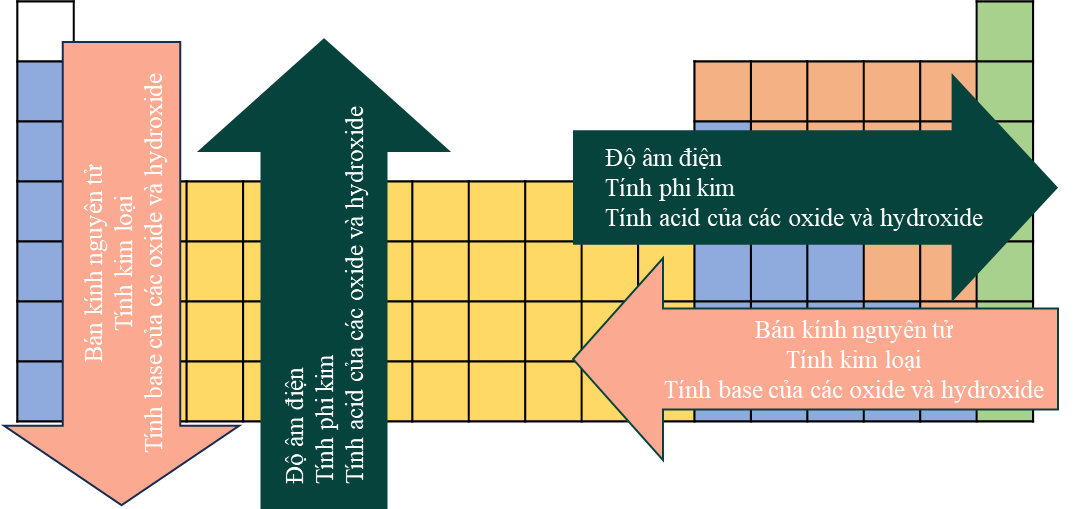
- Bán kính nguyên tử: Tưởng tượng electron hóa trị như những đứa con ở xa bố (hạt nhân). Càng ở xa, lực hút của bố càng yếu đi, và đứa con đó càng dễ "đi chơi xa" (bị nhường đi). Vì vậy, nguyên tử có bán kính lớn hơn thường có tính khử mạnh hơn.
- Độ âm điện: Đây là thước đo mức độ "ích kỷ", khả năng hút electron của một nguyên tử. Nguyên tử có độ âm điện thấp nghĩa là nó không "tham" electron lắm, thậm chí còn sẵn sàng cho đi. Chất nào có nguyên tố với độ âm điện càng thấp thì tính khử càng mạnh.
- Năng lượng ion hóa: Đây là năng lượng cần thiết để "bứt" một electron ra khỏi nguyên tử. Năng lượng ion hóa càng thấp thì việc lấy đi electron càng dễ dàng, đồng nghĩa với tính khử càng mạnh. Yếu tố này liên quan chặt chẽ đến bán kính và độ âm điện.
Hiểu đơn giản, chất khử mạnh là chất có electron hóa trị bị hạt nhân giữ lại một cách lỏng lẻo, dễ dàng "nhả" ra khi gặp đối tác phù hợp.
Những "Anh Hùng" và "Người Thường" Trong Giới Khử
Dựa vào các yếu tố trên, chúng ta có thể phân loại các chất khử:
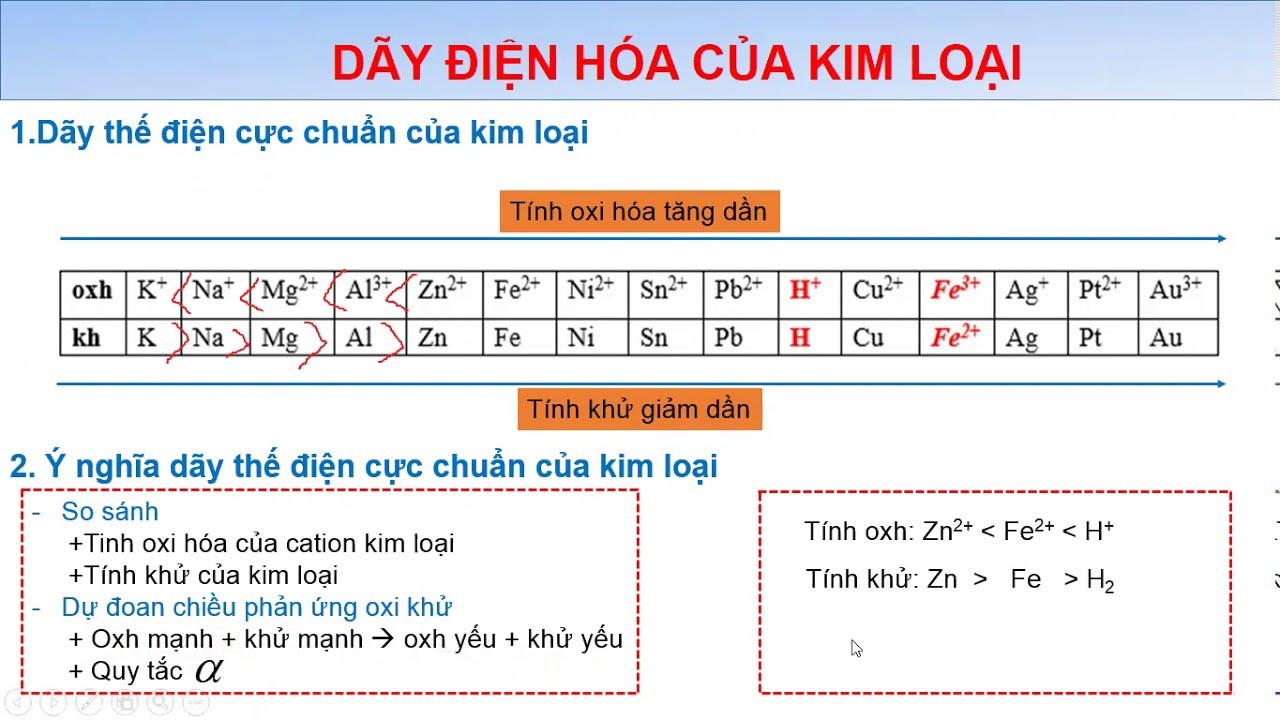
- Chất khử mạnh: Thường là các kim loại kiềm (nhóm IA) như Li, Na, K, Rb, Cs. Chúng có bán kính lớn nhất trong cùng chu kỳ, độ âm điện và năng lượng ion hóa cực thấp, nên khả năng nhường electron là "vô địch". Các kim loại kiềm thổ (nhóm IIA) như Ca, Ba cũng là chất khử mạnh. Một số chất khác như H₂ (trong nhiều phản ứng), các hợp chất hydrua kim loại (ví dụ: NaH, LiAlH₄) cũng thể hiện tính khử rất mạnh.
- Chất khử yếu: Là những chất không dễ dàng nhường electron. Ví dụ điển hình là các kim loại kém hoạt động như Cu, Ag, Au. Chúng có độ âm điện tương đối cao hơn và electron hóa trị bị giữ chặt hơn. Một số phi kim như S, C cũng có thể đóng vai trò chất khử nhưng thường cần điều kiện phản ứng nhất định (như nhiệt độ cao) và "sức mạnh" không bằng kim loại kiềm.
- Chất có tính khử "lưỡng tính" (vừa khử vừa oxi hóa): Thú vị là có những chất có thể đóng cả hai vai trò, tùy thuộc vào "đối tác" mà nó gặp. Điều này xảy ra khi nguyên tố trong chất đó đang ở trạng thái oxi hóa trung gian. Ví dụ kinh điển là H₂O₂ (nước oxy già). Nó có thể nhường electron (bị oxi hóa thành O₂) khi gặp chất oxi hóa mạnh hơn, hoặc nhận electron (bị khử thành H₂O) khi gặp chất khử mạnh hơn. Tương tự, SO₂ có thể bị oxi hóa lên SO₃ hoặc bị khử xuống S hay H₂S. Các ion kim loại ở trạng thái oxi hóa trung gian như Fe²⁺ cũng vậy, có thể bị oxi hóa thành Fe³⁺ hoặc bị khử thành Fe.
Việc biết được chất nào mạnh, chất nào yếu, và chất nào "đa năng" giúp chúng ta dự đoán và kiểm soát các phản ứng hóa học một cách hiệu quả hơn.
Phản Ứng Oxi Hóa Khử: Động Cơ Vận Hành Thế Giới Quanh Ta
Bạn biết không, thế giới quanh ta, từ những thứ vĩ mô như nhà máy công nghiệp cho đến những quá trình nhỏ bé trong cơ thể mình, đều đang diễn ra hàng tỷ tỷ phản ứng hóa học. Và trong số đó, phản ứng oxi hóa khử đóng vai trò như một động cơ mạnh mẽ, thầm lặng nhưng cực kỳ quan trọng. Đây không chỉ là lý thuyết khô khan trong sách vở đâu nhé, mà nó hiện diện khắp mọi nơi, quyết định sự tồn tại và phát triển của biết bao thứ.
Hãy thử nhìn vào ngành luyện kim chẳng hạn. Để có được những thanh sắt, nhôm, đồng mà chúng ta dùng hàng ngày, người ta phải "lôi" chúng ra khỏi quặng mỏ. Quặng kim loại thường tồn tại dưới dạng hợp chất bị oxi hóa. Công đoạn "lôi" này chính là quá trình khử ion kim loại về dạng nguyên tố kim loại. Các chất khử mạnh mẽ như than cốc (carbon) hay khí CO được dùng để "nhường" electron cho ion kim loại, giúp chúng trở lại trạng thái kim loại nguyên chất. Không có phản ứng oxi hóa khử, chúng ta sẽ không có kim loại để xây nhà, làm xe, hay sản xuất đủ thứ đồ dùng.
Rồi đến chuyện làm đẹp hay bảo vệ bề mặt kim loại bằng mạ điện. Đây là một ứng dụng cực kỳ hay ho của phản ứng oxi hóa khử dùng điện năng. Khi bạn mạ vàng, mạ bạc hay mạ crom lên một vật nào đó, thực chất là các ion kim loại trong dung dịch đã nhận electron (bị khử) và bám dính lên bề mặt vật cần mạ. Đồng thời, ở cực còn lại, sẽ có quá trình oxi hóa diễn ra để hoàn thành mạch điện. Quá trình này giúp vật liệu bền hơn, đẹp hơn, chống ăn mòn tốt hơn.
Ngay cả việc xử lý môi trường cũng cần đến "bàn tay" của phản ứng oxi hóa khử. Những chất thải độc hại trong nước hay không khí, nhiều khi rất khó phân hủy bằng các phương pháp thông thường. Người ta dùng các chất oxi hóa mạnh như ozon (O₃) hay hydro peoxit (H₂O₂) để "tấn công", phá vỡ cấu trúc của các chất ô nhiễm phức tạp thành những chất đơn giản, ít độc hơn hoặc dễ xử lý hơn. Ngược lại, đôi khi cần khử các ion kim loại nặng độc hại về dạng kết tủa để loại bỏ chúng.
Nguồn năng lượng mà chúng ta sử dụng hàng ngày cũng gắn liền với phản ứng oxi hóa khử. Sản xuất năng lượng từ việc đốt nhiên liệu (như xăng, gas, than) chính là quá trình oxi hóa nhanh chóng, giải phóng nhiệt và ánh sáng. Trong các loại pin hay ắc quy mà bạn dùng cho điện thoại, xe cộ, là nơi diễn ra các phản ứng oxi hóa khử có kiểm soát, chuyển hóa năng năng lượng hóa học thành điện năng. Cực dương bị oxi hóa, cực âm bị khử, và dòng electron tạo ra dòng điện. Tương tự, pin nhiên liệu cũng hoạt động dựa trên nguyên tắc này, nhưng hiệu quả và sạch hơn.
Trong lĩnh vực dược phẩm, phản ứng oxi hóa khử tham gia vào nhiều công đoạn tổng hợp các loại thuốc phức tạp. Hơn nữa, nhiều loại thuốc hoạt động như những chất chống oxi hóa, giúp bảo vệ tế bào khỏi bị tổn thương bởi các gốc tự do (những phân tử rất dễ gây ra phản ứng oxi hóa không mong muốn trong cơ thể). Ngược lại, một số chất khử lại được dùng trong các ứng dụng y tế khác.
Và cuối cùng, không thể không nhắc đến vai trò của chúng trong thực phẩm. Quá trình thực phẩm bị ôi thiu, hỏng, nhiều khi là do bị oxi hóa bởi không khí. Để giữ cho thực phẩm tươi ngon lâu hơn, người ta thường thêm vào các chất chống oxi hóa tự nhiên hoặc tổng hợp (như Vitamin C, Vitamin E). Ngay cả quá trình tiêu hóa thức ăn trong cơ thể chúng ta cũng bao gồm vô số phản ứng oxi hóa khử phức tạp, giúp chuyển hóa năng lượng từ thực phẩm thành năng lượng cho cơ thể hoạt động. Quá trình hô hấp tế bào chính là một chuỗi phản ứng oxi hóa khử khổng lồ, giải phóng năng lượng từ glucose.
Thấy chưa, phản ứng oxi hóa khử không hề xa lạ hay chỉ tồn tại trong phòng thí nghiệm. Chúng là những "người hùng thầm lặng", vận hành và duy trì rất nhiều khía cạnh quan trọng của cuộc sống hiện đại và cả sự sống trên hành tinh này nữa đấy!