Bạn có biết, thế giới quanh ta tràn ngập những "dung dịch"? Từ ly cà phê buổi sáng giúp bạn tỉnh táo, nước biển mặn mòi chứa đựng bao bí ẩn, cho đến chính không khí trong lành chúng ta hít thở hàng ngày – tất cả đều là những ví dụ điển hình về dung dịch. Thoạt nhìn có vẻ đơn giản, nhưng đằng sau khái niệm này là cả một lĩnh vực khoa học thú vị, giải thích tại sao đường tan trong nước, hay làm thế nào thuốc được đưa vào cơ thể hiệu quả. Vậy, điều gì tạo nên một dung dịch hoàn hảo, và chúng đóng vai trò quan trọng đến mức nào trong cuộc sống, công nghiệp hay y học? Hãy cùng "giải mã" tất tần tật về thế giới kỳ diệu này nhé!
Dung dịch là gì Thành phần chính tạo nên
Bạn có bao giờ tự hỏi tại sao nước muối lại trong veo, hay nước đường lại ngọt lịm mà không thấy hạt đường đâu không? Bí mật nằm ở "dung dịch" đấy! Nói một cách đơn giản, dung dịch là một loại hỗn hợp cực kỳ đặc biệt. Nó không phải là hai hay nhiều chất trộn lẫn vào nhau một cách lộn xộn, mà là một sự kết hợp đồng nhất hoàn hảo. Nghĩa là, dù bạn lấy một giọt ở đâu trong cốc nước muối đó, thành phần của nó cũng y chang như những giọt còn lại. Toàn bộ hỗn hợp chỉ tồn tại ở một pha duy nhất, có thể là lỏng, rắn hoặc khí.
Để tạo nên một dung dịch, chúng ta cần ít nhất hai "ngôi sao" chính: chất tan và dung môi. Hãy hình dung thế này, dung môi giống như một "sân chơi" rộng lớn, còn chất tan là những "người chơi" tí hon. Chất tan là chất bị hòa tan, tan biến vào trong dung môi. Ví dụ, khi bạn pha đường vào nước, đường là chất tan. Ngược lại, dung môi là chất có khả năng hòa tan chất khác vào nó. Trong ví dụ nước đường, nước chính là dung môi. Thường thì, dung môi là chất có số lượng nhiều hơn trong hỗn hợp.
Vậy điều gì làm cho dung dịch khác biệt với những hỗn hợp thông thường khác? Đó chính là những tính chất đặc trưng không lẫn vào đâu được. Đầu tiên và quan trọng nhất là tính đồng nhất như đã nói, mọi ngóc ngách của dung dịch đều có thành phần như nhau. Thứ hai, dung dịch thường có độ trong suốt. Ánh sáng có thể đi xuyên qua chúng mà không bị phân tán mạnh, khác hẳn với nước đục hay sữa. Và điều tuyệt vời nữa là tính ổn định. Các hạt chất tan đã tan vào rồi thì sẽ ở yên đó, không bao giờ lắng xuống đáy hay tách lớp theo thời gian, dù bạn có để yên bao lâu đi chăng nữa.
Chính nhờ những tính chất này mà dung dịch hoàn toàn khác biệt với các "anh em" hỗn hợp không đồng nhất. Bạn đã nghe về huyền phù hay nhũ tương chưa? Huyền phù là hỗn hợp có các hạt rắn lơ lửng trong chất lỏng, nhìn thấy rõ bằng mắt thường và sẽ lắng xuống nếu để yên (như nước phù sa). Nhũ tương lại là hỗn hợp của hai chất lỏng không hòa tan vào nhau, tạo thành các giọt nhỏ li ti phân tán (như dầu ăn trong nước khi chưa khuấy đều, hoặc sữa tươi). Trong khi đó, các hạt chất tan trong dung dịch lại cực kỳ nhỏ, chỉ ở cấp độ phân tử hoặc ion, mắt thường không thể nhìn thấy, và chúng "quyện" chặt vào dung môi, tạo nên một khối thống nhất bền vững. Đó là lý do tại sao nước muối luôn trong và không bao giờ thấy hạt muối đọng lại.
Phân loại dung dịch: Trạng thái và độ ‘no’ của chất tan
À, nói đến dung dịch, nhiều người thường chỉ nghĩ ngay đến nước muối hay nước đường, tức là chất rắn tan trong chất lỏng đúng không? Nhưng thực tế, thế giới dung dịch rộng lớn và đa dạng hơn nhiều đấy! Chúng ta có thể phân loại chúng dựa trên hai tiêu chí chính, nghe qua là hiểu ngay thôi.
Đầu tiên là dựa vào trạng thái vật lý của dung môi. Dung môi là cái "nền" để chất tan "ngụ cư" vào mà. Dung môi có thể là khí, lỏng, hoặc rắn.
- Dung dịch khí: Nghe có vẻ lạ đúng không? Nhưng không khí chúng ta hít thở hàng ngày chính là một ví dụ điển hình đấy. Nitơ (N₂) chiếm phần lớn, đóng vai trò như dung môi, còn oxy (O₂), argon (Ar), carbon dioxide (CO₂)… là chất tan. Tất cả hòa quyện vào nhau tạo thành một hỗn hợp đồng nhất, một pha duy nhất.
- Dung dịch lỏng: Đây là loại quen thuộc nhất rồi. Dung môi ở trạng thái lỏng, thường là nước, cồn, hay các dung môi hữu cơ khác. Chất tan có thể là rắn (như muối, đường tan trong nước), lỏng (như cồn tan trong nước), hoặc khí (như khí CO₂ tan trong nước ngọt có gas). Nước biển, giấm ăn, nước giải khát… đều thuộc nhóm này.
- Dung dịch rắn: Thú vị chưa? Ngay cả chất rắn cũng có thể là dung dịch! Chúng thường là các hợp kim, nơi một kim loại (hoặc phi kim) tan vào mạng lưới tinh thể của một kim loại khác. Ví dụ như đồng thau là dung dịch rắn của kẽm tan trong đồng, hay thép không gỉ là dung dịch rắn của crom và niken tan trong sắt. Chúng đồng nhất và có tính chất khác biệt so với các thành phần ban đầu.
Tiêu chí thứ hai để phân loại dung dịch là dựa vào mức độ hòa tan hay còn gọi là độ bão hòa của chất tan trong dung môi ở một điều kiện nhất định (thường là nhiệt độ và áp suất xác định). Kiểu như cái cốc nước của bạn có thể "chứa" được bao nhiêu đường ấy mà.
- Dung dịch chưa bão hòa: Đây là dung dịch mà chất tan vẫn còn có thể hòa tan thêm được nữa. Giống như bạn vẫn còn "đói", có thể ăn thêm đồ ăn vậy. Nếu bạn cho thêm chất tan vào dung dịch chưa bão hòa, nó sẽ tiếp tục tan ra.
- Dung dịch bão hòa: Lúc này, dung dịch đã "no" rồi. Nó đã hòa tan lượng chất tan tối đa có thể ở nhiệt độ và áp suất đó. Nếu bạn cố gắng cho thêm chất tan vào, phần chất tan thêm vào sẽ không tan nữa mà lắng xuống đáy hoặc lơ lửng trong dung dịch. Trạng thái cân bằng giữa quá trình hòa tan và kết tinh đã đạt được.
- Dung dịch quá bão hòa: Loại này hơi đặc biệt và không ổn định lắm. Nó chứa một lượng chất tan nhiều hơn so với dung dịch bão hòa ở cùng điều kiện. Kiểu như bạn cố nhồi nhét thêm đồ ăn khi đã no căng bụng vậy. Dung dịch quá bão hòa thường được tạo ra bằng cách hòa tan chất tan ở nhiệt độ cao rồi làm nguội từ từ mà không bị khuấy động. Chỉ cần một tác động nhỏ như khuấy nhẹ, thêm một tinh thể chất tan nhỏ xíu, hoặc thậm chí là rung động, lượng chất tan dư thừa sẽ kết tinh đột ngột và lắng xuống, đưa dung dịch trở về trạng thái bão hòa.
Hiểu được cách phân loại này giúp chúng ta nhìn nhận dung dịch một cách toàn diện hơn, không chỉ giới hạn trong những chất lỏng quen thuộc mà còn mở rộng ra cả thế giới khí và rắn nữa đấy!
Khám phá những yếu tố ảnh hưởng đến sự hòa tan
Bạn có bao giờ tự hỏi vì sao đường tan nhanh trong nước nóng nhưng lại "lề mề" trong nước lạnh? Hay tại sao muối ăn dễ dàng biến mất trong nước, còn dầu ăn thì cứ "chơi vơi" mãi không chịu hòa lẫn? Tất cả đều nằm ở những bí mật đằng sau quá trình hòa tan đấy. Sự hòa tan không phải lúc nào cũng diễn ra như nhau, nó phụ thuộc vào nhiều yếu tố khác nhau, quyết định cả khả năng một chất có tan được hay không và tốc độ nó tan nhanh hay chậm.
Đầu tiên, phải kể đến "tính cách" của chính các "nhân vật" tham gia vào cuộc chơi này: chất tan và dung môi. Cứ như kiểu "ngưu tầm ngưu, mã tầm mã" vậy đó. Các chất có bản chất hóa học tương đồng thường dễ dàng hòa tan vào nhau. Nước là một dung môi phân cực, nên nó rất "hợp cạ" với các chất phân cực hoặc ion như muối ăn (NaCl) hay đường (saccharose). Ngược lại, dầu ăn hay xăng là những chất không phân cực, chúng lại thích "kết thân" với nhau hơn là với nước. Đây chính là lý do vì sao nước và dầu không bao giờ chịu hòa lẫn vào nhau thành một thể đồng nhất.
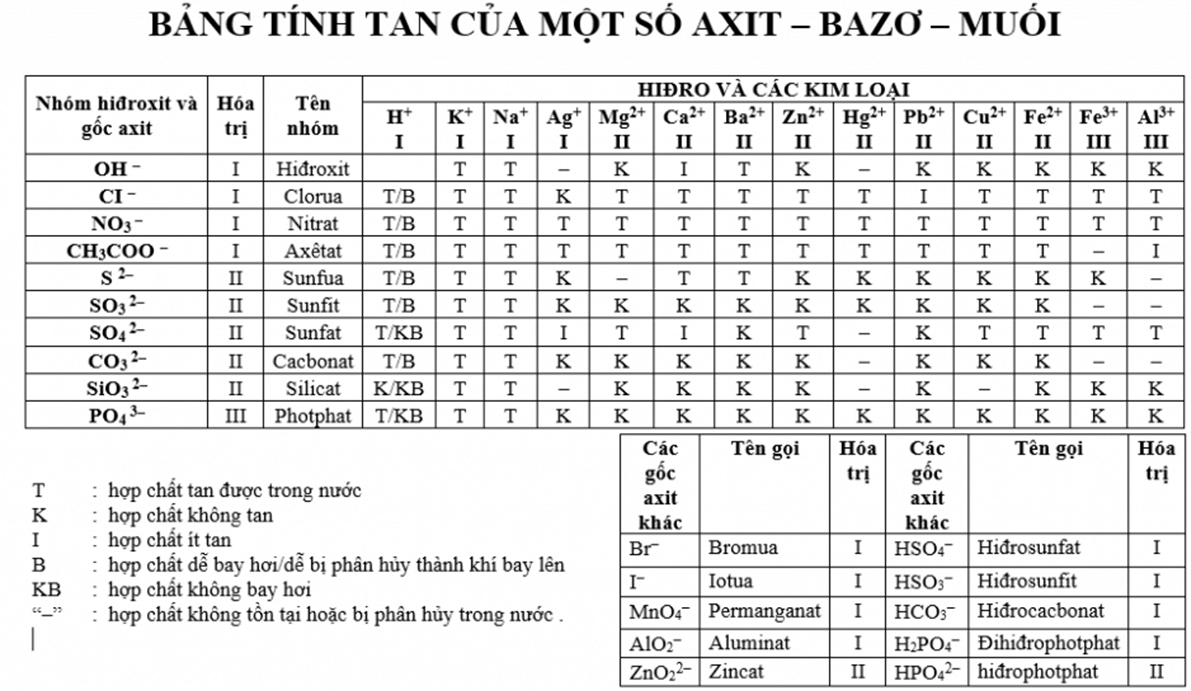
Nhiệt độ cũng là một "nhân tố" cực kỳ quan trọng. Thử nghĩ xem, pha một ly trà đá đường có khó hơn pha một ly trà nóng đường không? Chắc chắn là có rồi! Đối với hầu hết các chất rắn, khi nhiệt độ tăng, khả năng hòa tan của chúng trong dung môi lỏng cũng tăng theo. Các hạt chất tan và dung môi đều chuyển động nhanh hơn, va chạm nhiều và mạnh hơn, giúp quá trình "chen chân" vào nhau dễ dàng hơn. Tuy nhiên, với chất khí thì ngược lại nhé. Khi nhiệt độ tăng, độ tan của khí trong chất lỏng lại giảm đi. Đây là lý do vì sao lon nước ngọt để ngoài nắng sẽ nhanh chóng bị "xì hơi" và mất đi vị gas đặc trưng.
Áp suất cũng có tiếng nói riêng, đặc biệt là khi nói về sự hòa tan của chất khí trong chất lỏng. Bạn để ý chai nước ngọt khi chưa mở nắp không? Bên trong là khí CO2 được nén dưới áp suất cao, nên nó hòa tan rất nhiều vào nước. Khi bạn bật nắp, áp suất đột ngột giảm xuống, "sức ép" không còn nữa, khí CO2 lập tức "thoát ra ngoài" tạo thành bọt sủi tăm. Điều này cho thấy áp suất càng cao, chất khí càng dễ tan trong chất lỏng (trong một giới hạn nhất định).
Bên cạnh việc quyết định lượng chất tan có thể hòa tan, các yếu tố còn ảnh hưởng đến tốc độ hòa tan nữa. Giả sử bạn muốn đường tan nhanh hơn trong ly trà nóng, bạn sẽ làm gì? Chắc chắn là khuấy rồi! Việc khuấy trộn liên tục giúp đưa lớp dung môi "tươi" chưa bão hòa tiếp xúc với bề mặt chất tan, đồng thời đưa lớp dung dịch đã bão hòa ra xa, tạo điều kiện cho chất tan tiếp tục hòa vào.
Nghiền nhỏ chất rắn cũng là một "chiêu" hiệu quả để tăng tốc độ hòa tan. Thử so sánh viên đường phèn với đường cát xem, loại nào tan nhanh hơn? Rõ ràng là đường cát rồi, đúng không nào? Khi bạn nghiền nhỏ chất rắn, bạn đã tăng đáng kể diện tích bề mặt tiếp xúc giữa chất tan và dung môi. Càng nhiều "điểm chạm", quá trình hòa tan diễn ra càng nhanh.
Cuối cùng, nhiệt độ không chỉ ảnh hưởng đến khả năng hòa tan mà còn tác động mạnh mẽ đến tốc độ hòa tan, đặc biệt là chất rắn. Nước nóng giúp các hạt chuyển động nhanh hơn, va chạm hiệu quả hơn, từ đó đẩy nhanh quá trình "tan chảy" của chất rắn.
Hiểu rõ những yếu tố này giúp chúng ta kiểm soát và ứng dụng quá trình hòa tan một cách hiệu quả trong cuộc sống hàng ngày cũng như trong các ngành công nghiệp phức tạp.
Nồng độ dung dịch thước đo chuẩn
Bạn có bao giờ tự hỏi tại sao ly cà phê này đậm hơn ly kia? Hay tại sao chai nước muối sinh lý lại có nồng độ cố định 0.9%? Bí mật nằm ở khái niệm "độ đậm đặc", mà trong hóa học chúng ta gọi là nồng độ dung dịch.
Nói nôm na, nồng độ cho chúng ta biết lượng chất tan (thứ được hòa tan) nhiều hay ít so với lượng dung môi (thứ đi hòa tan) hoặc toàn bộ dung dịch. Nó giống như việc bạn đong đếm xem cho bao nhiêu đường vào cốc nước vậy. Có nhiều cách để đo lường "độ đậm đặc" này, nhưng phổ biến nhất phải kể đến nồng độ phần trăm và nồng độ mol.
Nồng độ phần trăm đơn giản dễ hiểu
Đây là loại nồng độ quen thuộc nhất trong đời sống hàng ngày. Nồng độ phần trăm, ký hiệu là C%, cho biết khối lượng chất tan chiếm bao nhiêu phần trăm trong tổng khối lượng của dung dịch. Đơn giản là lấy khối lượng chất tan chia cho khối lượng dung dịch rồi nhân với 100%.
Công thức tính C% là:
C% = (khối lượng chất tan / khối lượng dung dịch) * 100%
Ví dụ, khi bạn thấy chai nước muối ghi 5%, nghĩa là cứ 100 gram dung dịch nước muối đó thì có 5 gram muối. Loại nồng độ này cực kỳ tiện lợi khi làm việc với các sản phẩm tiêu dùng, thực phẩm, hay một số loại thuốc pha chế đơn giản. Nó trực quan và dễ hình dung.
Nồng độ mol thước đo chuẩn xác cho nhà khoa học
Trong phòng thí nghiệm hay các ngành công nghiệp cần độ chính xác cao, người ta thường dùng nồng độ mol, ký hiệu là CM (hoặc M). Nồng độ mol cho biết số mol chất tan có trong một lít dung dịch. Khác với C% dùng khối lượng, CM dùng đơn vị mol và thể tích.
Công thức tính CM là:
CM = số mol chất tan / thể tích dung dịch (lít)
Đơn vị của nồng độ mol là mol/lít, thường được viết tắt là M. Ví dụ, dung dịch axit HCl 1M nghĩa là trong mỗi lít dung dịch đó có chứa 1 mol phân tử HCl. Đơn vị mol nghe có vẻ phức tạp, nhưng nó là cách chuẩn để các nhà khoa học đếm số lượng hạt (nguyên tử, phân tử, ion) trong một lượng chất, giúp việc tính toán phản ứng hóa học trở nên chính xác hơn rất nhiều. Nồng độ mol cực kỳ quan trọng trong hóa học phân tích, hóa hữu cơ và nhiều quy trình công nghiệp phức tạp.
Hiểu rõ nồng độ phần trăm và nồng độ mol giúp chúng ta không chỉ biết dung dịch "đậm đặc" đến đâu, mà còn tính toán chính xác lượng chất cần dùng hay cần pha chế cho phù hợp với mục đích sử dụng, từ việc nấu ăn hàng ngày đến những thí nghiệm khoa học đòi hỏi sự tỉ mỉ.
Dung dịch quanh ta
Hoá ra, dung dịch không chỉ là khái niệm khô khan trong sách vở mà hiện diện khắp mọi ngóc ngách của cuộc sống. Từ ly cà phê buổi sáng, chai nước muối sinh lý, cho đến không khí chúng ta hít thở hàng ngày, chúng đóng vai trò then chốt trong vô vàn lĩnh vực, từ công nghiệp nặng đến y học hiện đại, từ bếp nhà đến phòng thí nghiệm tinh vi. Bạn có bao giờ dừng lại và tự hỏi, cuộc sống của chúng ta sẽ ra sao nếu thiếu vắng những hỗn hợp đồng nhất quen thuộc này? Hãy cùng khám phá xem, dung dịch đã "len lỏi" và tạo nên những thay đổi đáng kinh ngạc như thế nào trong thế giới quanh ta.
Dung dịch Quanh Ta Mỗi Ngày
Bạn có bao giờ để ý rằng thế giới xung quanh mình ngập tràn những "dung dịch" không? Thật đấy, chúng không chỉ loanh quanh trong phòng thí nghiệm đâu, mà len lỏi vào từng ngóc ngách cuộc sống, từ căn bếp nhỏ xíu đến những nhà máy khổng lồ. Chúng cứ âm thầm làm việc, giúp mọi thứ vận hành trơn tru hơn, đến mức đôi khi ta chẳng nhận ra sự hiện diện quen thuộc ấy.
Trong căn bếp nhà mình, dung dịch là "ngôi sao" đấy nhé. Nước mắm, nước tương bạn dùng nêm nếm? Đó là dung dịch. Nước đường pha chanh giải khát ngày hè? Cũng là dung dịch. Ngay cả ly cà phê buổi sáng hay tách trà chiều thơm lừng, bản chất cũng là các chất hòa tan trong nước. Chúng giúp hương vị lan tỏa, màu sắc bắt mắt, và quan trọng nhất là đưa các chất dinh dưỡng (hoặc caffeine!) đến cơ thể mình một cách dễ dàng. Khi nấu ăn, việc hòa tan gia vị vào nước hoặc dầu giúp chúng ngấm đều vào thực phẩm, tạo nên món ăn ngon miệng, đậm đà hơn.
Rồi đến việc nhà cửa sạch sẽ tinh tươm. Nước lau sàn, nước rửa chén, hay nước xả vải… tất cả đều là dung dịch. Các chất tẩy rửa, làm mềm vải được "cõng" bởi dung môi (thường là nước) để tiếp cận và làm sạch bụi bẩn, vết ố. Nhờ có chúng, việc dọn dẹp trở nên nhẹ nhàng và hiệu quả hơn bao giờ hết. Ngành công nghiệp thực phẩm và đồ uống cũng phụ thuộc rất nhiều vào dung dịch, từ việc pha chế nước giải khát có ga (khí CO2 hòa tan trong nước) đến sản xuất nước ép trái cây, sữa…

Không chỉ trong nhà, bước chân ra ngoài, vào các khu công nghiệp, dung dịch lại càng đóng vai trò "đinh". Ngành hóa chất thì khỏi phải nói, từ sản xuất axit, bazơ, muối cho đến phân bón, thuốc trừ sâu… hầu hết các phản ứng hóa học quan trọng đều diễn ra trong môi trường dung dịch. Điều này giúp kiểm soát phản ứng tốt hơn, tăng hiệu quả sản xuất và đảm bảo an toàn.
Ngành vật liệu xây dựng cũng cần đến dung dịch lắm. Ví dụ điển hình nhất là bê tông. Nước đóng vai trò dung môi để xi măng thủy hóa, tạo nên hỗn hợp vữa kết dính các loại đá, cát lại với nhau, cuối cùng đông cứng thành khối bê tông vững chắc, tạo nên nền móng cho biết bao công trình. Sơn tường bạn nhìn thấy cũng là hỗn hợp các hạt màu được phân tán hoặc hòa tan trong dung môi, giúp chúng bám dính và tạo màu cho bề mặt, làm đẹp cho không gian sống và làm việc.
Tóm lại, dù là pha một ly nước cam đơn giản hay sản xuất hàng tấn hóa chất phức tạp, dung dịch luôn là thành phần không thể thiếu, là "người bạn" thầm lặng nhưng cực kỳ quan trọng, đóng góp to lớn vào sự tiện nghi và phát triển của cuộc sống hiện đại, từ những điều nhỏ nhặt nhất đến những công trình vĩ đại.
Thuốc dạng lỏng: Chế phẩm đặc biệt trong y học
Trong thế giới thuốc men đa dạng, dung dịch thuốc chiếm một vị trí cực kỳ quan trọng. Đây không chỉ đơn thuần là thuốc được hòa tan trong nước hay chất lỏng nào đó, mà là một dạng bào chế đặc biệt, được nghiên cứu và sản xuất cẩn thận để đảm bảo hiệu quả điều trị tốt nhất khi đưa vào cơ thể.
Thành phần của một dung dịch thuốc thường gồm ba "người bạn" chính: hoạt chất, dung môi và tá dược. Hoạt chất chính là "linh hồn" của thuốc, là chất có tác dụng chữa bệnh. Dung môi là chất lỏng dùng để hòa tan hoạt chất, phổ biến nhất là nước tinh khiết, nhưng đôi khi cũng có thể là cồn, glycerin, hoặc các loại dầu đặc biệt tùy thuộc vào tính chất của hoạt chất. Còn tá dược thì giống như những "người trợ giúp" đắc lực, chúng không có tác dụng điều trị chính nhưng lại giúp ổn định hoạt chất, cải thiện mùi vị (quan trọng lắm với thuốc cho trẻ em!), tạo màu sắc hấp dẫn hơn, hoặc giúp hoạt chất dễ hòa tan và hấp thu hơn.
Vậy tại sao dung dịch thuốc lại được ưa chuộng đến vậy? Ưu điểm đầu tiên phải kể đến là sự dễ dàng khi sử dụng. Với những người gặp khó khăn khi nuốt viên nén hay viên nang, đặc biệt là trẻ nhỏ, người già hoặc bệnh nhân nặng, thuốc dạng lỏng là một lựa chọn tuyệt vời. Chỉ cần đong đúng liều bằng thìa hoặc ống nhỏ giọt là xong. Thứ hai, hoạt chất trong dung dịch thường được hấp thu rất nhanh vào máu. Vì nó đã ở dạng hòa tan sẵn rồi, cơ thể không cần mất thời gian để "phá vỡ" viên thuốc rắn nữa, nên tác dụng thường đến nhanh hơn. Cuối cùng, dung dịch thuốc cho phép điều chỉnh liều lượng một cách linh hoạt và chính xác hơn, đặc biệt khi cần những liều rất nhỏ hoặc cần thay đổi liều theo từng giai đoạn điều trị.
Tuy nhiên, dung dịch thuốc cũng có những "điểm yếu" riêng. Nhược điểm đáng lưu ý nhất là tính ổn định. Hoạt chất khi ở dạng dung dịch thường kém bền vững hơn so với khi ở dạng rắn. Chúng dễ bị phân hủy bởi ánh sáng, nhiệt độ, hoặc phản ứng với các thành phần khác trong môi trường lỏng. Điều này dẫn đến yêu cầu về bảo quản khắt khe hơn. Nhiều loại dung dịch thuốc cần được giữ ở nhiệt độ mát, tránh ánh sáng trực tiếp, và có hạn sử dụng ngắn hơn sau khi mở nắp so với thuốc viên. Ngoài ra, môi trường lỏng cũng dễ bị nhiễm khuẩn hơn nếu không được bảo quản đúng cách.
Dù có những thách thức về bảo quản, dung dịch thuốc vẫn là một chế phẩm không thể thiếu trong y học hiện đại, mang lại sự tiện lợi và hiệu quả điều trị cho rất nhiều đối tượng bệnh nhân.
Pha Dung Dịch Đúng Chuẩn An Toàn Tuyệt Đối
Pha chế dung dịch nghe có vẻ hơi "khoa học" nhỉ? Nhưng thực ra nó gần gũi lắm, từ việc pha một ly nước chanh đường cho đến làm thuốc trong y học hay sản xuất hóa chất công nghiệp. Quan trọng là phải làm đúng và an toàn.
Trước khi "nhúng tay" vào, phải làm toán cái đã. Đây là bước tính toán lượng chất tan và dung môi cần thiết để đạt được nồng độ mong muốn. Có hai loại nồng độ phổ biến mà bạn hay gặp:
- Nồng độ phần trăm (C%): Kiểu này dễ hiểu nè, nó cho biết có bao nhiêu gam chất tan trong 100 gam (hoặc 100 ml) dung dịch. Công thức đơn giản là:
C% = (Khối lượng chất tan / Khối lượng dung dịch) * 100%
Hoặc đôi khi là:
C% = (Khối lượng chất tan / Thể tích dung dịch) * 100% (thường dùng cho dung dịch lỏng) - Nồng độ mol (CM): Cái này "chuyên nghiệp" hơn tí, cho biết có bao nhiêu mol chất tan trong 1 lít dung dịch. Mol là đơn vị đo lượng chất á. Công thức tính là:
CM = Số mol chất tan / Thể tích dung dịch (tính bằng lít)
Tính toán xong xuôi rồi, giờ thì bắt tay vào pha thôi. Quy trình chung thường là:
- Cân hoặc đong chất tan: Dùng cân chính xác để cân lượng chất rắn hoặc ống đong/pipet để đong lượng chất lỏng theo tính toán.
- Hòa tan chất tan: Cho chất tan vào một lượng nhỏ dung môi phù hợp (thường là dung môi chính). Khuấy đều cho chất tan tan hết. Đôi khi cần gia nhiệt nhẹ hoặc khuấy mạnh hơn.
- Thêm dung môi và định mức: Thêm từ từ dung môi vào cho đến khi đạt được thể tích hoặc khối lượng dung dịch mong muốn. Nếu dùng bình định mức, thêm dung môi cho đến vạch chia trên bình.
- Khuấy đều lần cuối: Đảm bảo toàn bộ dung dịch đồng nhất.
Nhưng này, quan trọng nhất là an toàn nhé! Đặc biệt khi làm việc với hóa chất. Vài lưu ý "khắc cốt ghi tâm":
- Trang bị bảo hộ: Luôn đeo kính bảo hộ để tránh hóa chất bắn vào mắt. Đeo găng tay phù hợp (cao su, nitrile…) khi tiếp xúc với hóa chất ăn mòn hoặc độc hại. Mặc áo choàng hoặc tạp dề để bảo vệ quần áo và da.
- Làm việc nơi thoáng khí: Một số hóa chất có thể bay hơi và gây hại đường hô hấp. Nên pha chế ở nơi thoáng khí tốt hoặc dưới tủ hút.
- Đọc kỹ nhãn hóa chất: Hiểu rõ tính chất, mức độ nguy hiểm và cách xử lý an toàn của hóa chất bạn đang dùng.
- Thao tác cẩn thận: Tránh làm đổ, văng hóa chất. Không hít trực tiếp hơi hóa chất.
- Xử lý sự cố: Biết cách xử lý khi hóa chất bị đổ (dùng vật liệu thấm hút, trung hòa nếu cần) và sơ cứu khi hóa chất dính vào da hoặc mắt (rửa ngay dưới vòi nước sạch).
- Không ăn uống trong khu vực pha chế: Tuyệt đối không!
Tóm lại, pha chế dung dịch không chỉ là làm đúng công thức toán học. Đó còn là cả một quy trình đòi hỏi sự tỉ mỉ, cẩn thận và đặc biệt là tuân thủ nghiêm ngặt các quy tắc an toàn để đảm bảo kết quả chính xác và bảo vệ sức khỏe của chính mình.