Bạn có bao giờ thắc mắc tại sao khi đốt một que diêm lại thấy nóng và có lửa, hay vì sao túi chườm lạnh lại có thể hạ nhiệt nhanh chóng chỉ bằng một cái bóp nhẹ? Đằng sau những hiện tượng quen thuộc trong cuộc sống hàng ngày ấy chính là sự trao đổi năng lượng đầy kỳ diệu của thế giới hóa học. Có những phản ứng khi xảy ra sẽ "phóng thích" năng lượng ra môi trường xung quanh dưới dạng nhiệt, ánh sáng hoặc âm thanh – chúng ta gọi đó là phản ứng tỏa nhiệt. Ngược lại, có những phản ứng lại cần "hút" năng lượng từ môi trường để có thể diễn ra, giống như cây xanh cần ánh sáng mặt trời để lớn lên vậy; đó là phản ứng thu nhiệt. Vậy làm thế nào để phân biệt chúng một cách rõ ràng, và sự khác biệt này mang ý nghĩa gì đối với cuộc sống và công nghiệp của chúng ta?

Phản ứng tỏa nhiệt là gì và dấu hiệu nhận biết
Bạn có bao giờ thấy một phản ứng hóa học tự nhiên nóng lên chưa? Đó chính là phản ứng tỏa nhiệt đấy! Hiểu đơn giản, phản ứng tỏa nhiệt là những phản ứng mà trong quá trình diễn ra, năng lượng được giải phóng ra môi trường xung quanh. Năng lượng này thường xuất hiện dưới dạng nhiệt, làm cho mọi thứ xung quanh trở nên ấm hơn, thậm chí là nóng bừng. Đôi khi, năng lượng còn được giải phóng dưới dạng ánh sáng (như khi đốt lửa) hoặc âm thanh (như một vụ nổ nhỏ).

Vậy làm sao để nhận biết một phản ứng tỏa nhiệt ngay lập tức? Có vài dấu hiệu rất rõ ràng:
- Nhiệt độ tăng lên: Đây là dấu hiệu phổ biến và dễ nhận thấy nhất. Nếu bạn chạm vào bình phản ứng (một cách an toàn nhé!) hoặc đo nhiệt độ môi trường xung quanh, bạn sẽ thấy nó nóng lên đáng kể.
- Giải phóng nhiệt: Bạn có thể cảm nhận được hơi nóng tỏa ra. Tưởng tượng lúc đốt củi sưởi ấm, hơi nóng bốc lên chính là nhiệt năng được giải phóng từ phản ứng đốt cháy.
- Phát sáng: Nhiều phản ứng tỏa nhiệt đi kèm với việc phát ra ánh sáng. Ví dụ điển hình là ngọn lửa khi đốt cháy các chất.
- Phát ra âm thanh: Một số phản ứng tỏa nhiệt rất nhanh và mạnh có thể tạo ra âm thanh, như tiếng nổ lách tách hay thậm chí là tiếng nổ lớn.
Về bản chất, trong phản ứng tỏa nhiệt, năng lượng của các chất sản phẩm thấp hơn năng lượng của các chất tham gia. Phần năng lượng dư thừa đó không mất đi đâu cả, mà được đẩy ra ngoài môi trường, khiến môi trường nhận thêm năng lượng và nóng lên. Đây là lý do vì sao chúng ta dùng phản ứng tỏa nhiệt để tạo ra nhiệt sưởi ấm hay nấu nướng hàng ngày.
Phản ứng thu nhiệt Lấy năng lượng từ môi trường
Tưởng tượng một phản ứng hóa học mà thay vì "nhả" năng lượng ra ngoài, nó lại "hút" năng lượng vào trong từ môi trường xung quanh. Đó chính là bản chất của phản ứng thu nhiệt. Khác với phản ứng tỏa nhiệt làm nóng mọi thứ, phản ứng thu nhiệt lại khiến môi trường xung quanh nó bị lạnh đi, bởi vì nó đang "ăn" năng lượng của môi trường đó để tồn tại và diễn ra.

Vậy tại sao lại có chuyện "ăn" năng lượng như vậy? Đơn giản là để một phản ứng hóa học xảy ra, các liên kết cũ trong chất ban đầu cần bị phá vỡ. Việc phá vỡ liên kết này luôn cần năng lượng, giống như bạn cần sức để bẻ gãy một que củi vậy. Sau khi các liên kết cũ đứt rồi, các nguyên tử sẽ sắp xếp lại để tạo thành các liên kết mới trong sản phẩm. Việc tạo thành liên kết mới này lại giải phóng năng lượng.
Trong phản ứng thu nhiệt, có một sự "thâm hụt" năng lượng ở đây. Lượng năng lượng cần thiết để phá vỡ các liên kết ban đầu lớn hơn lượng năng lượng được giải phóng khi các liên kết mới hình thành. Cái phần năng lượng còn thiếu đó phải được bù đắp từ đâu? Chính là từ môi trường xung quanh! Phản ứng sẽ "rút" năng lượng (thường là nhiệt) từ môi trường để lấp đầy khoảng trống năng lượng này.
Chính vì cần một nguồn năng lượng "tiếp sức" từ bên ngoài để bù đắp sự thiếu hụt này, nên các phản ứng thu nhiệt thường không tự phát diễn ra một cách dễ dàng ở điều kiện thường. Chúng cần được "kích hoạt" hoặc duy trì bằng cách liên tục cung cấp năng lượng, ví dụ như đun nóng, chiếu sáng hoặc cho dòng điện chạy qua. Nếu không có nguồn năng lượng này, phản ứng có thể sẽ "đình công" và không xảy ra hoặc chỉ diễn ra rất chậm chạp.
So Sánh Đầy Đủ Tỏa Nhiệt và Thu Nhiệt
Sau khi đã hiểu rõ từng loại phản ứng, giờ là lúc đặt chúng cạnh nhau để thấy được sự khác biệt cốt lõi. Đây là những điểm mấu chốt giúp bạn phân biệt phản ứng tỏa nhiệt và thu nhiệt một cách rành mạch nhất.
Đầu tiên, hãy nói về sự trao đổi nhiệt với môi trường. Đây là đặc điểm dễ nhận biết nhất. Phản ứng tỏa nhiệt, đúng như tên gọi, là phản ứng "cho đi" nhiệt. Năng lượng dưới dạng nhiệt được giải phóng ra bên ngoài, khiến môi trường xung quanh nóng lên. Ngược lại, phản ứng thu nhiệt lại "nhận vào" nhiệt từ môi trường. Nó hút năng lượng xung quanh để có thể diễn ra, làm cho môi trường đó bị lạnh đi. Cứ hình dung một bên là cái lò sưởi, một bên là túi chườm lạnh vậy đó.

Tiếp theo là dấu của biến thiên enthalpy (ΔH). Đây là một chỉ số khoa học để đo lường sự thay đổi năng lượng trong phản ứng. Đối với phản ứng tỏa nhiệt, vì hệ phản ứng mất đi năng lượng (giải phóng ra ngoài), nên biến thiên enthalpy có giá trị âm (ΔH < 0). Giống như bạn chi tiền, số dư tài khoản giảm xuống vậy. Còn với phản ứng thu nhiệt, hệ phản ứng nhận thêm năng lượng từ môi trường, nên biến thiên enthalpy có giá trị dương (ΔH > 0). Cái này thì như bạn được cộng tiền vào tài khoản. Dấu của ΔH là cách nhanh nhất để các nhà hóa học biết phản ứng đó là tỏa nhiệt hay thu nhiệt khi nhìn vào phương trình.
Thứ ba là ảnh hưởng trực tiếp đến nhiệt độ môi trường xung quanh. Khi phản ứng tỏa nhiệt xảy ra, bạn sẽ cảm nhận được sự ấm lên, thậm chí là nóng bỏng nếu phản ứng mạnh. Nhiệt độ của bình phản ứng hoặc khu vực xung quanh sẽ tăng lên đáng kể. Ngược lại, phản ứng thu nhiệt sẽ làm nhiệt độ môi trường giảm xuống. Đôi khi, sự giảm nhiệt này rõ rệt đến mức bạn có thể thấy hơi nước ngưng tụ trên thành bình hoặc cảm thấy lạnh buốt khi chạm vào.
Cuối cùng, xét về tính tự phát của phản ứng. Nhiều phản ứng tỏa nhiệt có xu hướng tự diễn ra hoặc chỉ cần một kích thích ban đầu nhỏ (như mồi lửa cho phản ứng đốt cháy) là có thể tiếp tục mà không cần cung cấp năng lượng liên tục. Chúng thường khá "hăng hái". Phản ứng thu nhiệt thì khác, chúng thường không tự phát. Để phản ứng thu nhiệt xảy ra và duy trì, bạn cần phải liên tục cung cấp năng lượng từ bên ngoài, thường là dưới dạng nhiệt. Nếu ngừng cung cấp năng lượng, phản ứng có thể dừng lại ngay.
Tóm lại, sự khác biệt nằm ở hướng di chuyển của năng lượng: tỏa nhiệt đẩy năng lượng ra, thu nhiệt kéo năng lượng vào. Điều này dẫn đến những hệ quả rõ rệt về dấu ΔH, sự thay đổi nhiệt độ môi trường và khả năng tự diễn ra của phản ứng. Nắm chắc những điểm này là bạn đã hiểu sâu hơn về bản chất của hai loại phản ứng hóa học cơ bản này rồi đấy.
Phản ứng hóa học trong đời sống và công nghiệp
Vậy là chúng ta đã biết phản ứng hóa học có thể "nhả" năng lượng ra ngoài hoặc "hút" năng lượng vào. Nhưng liệu những điều thú vị này chỉ nằm trong sách vở hay phòng thí nghiệm? Nhìn quanh một chút, bạn sẽ thấy chúng hiện diện khắp nơi! Từ việc đốt củi sưởi ấm trong đêm đông, chiếc túi chườm lạnh cấp tốc cho vết bong gân, đến cả quá trình cây xanh "chế biến" ánh sáng mặt trời thành thức ăn – tất cả đều là những minh chứng rõ nét. Vậy làm thế nào mà những phản ứng tưởng chừng đơn giản này lại có sức ảnh hưởng lớn lao, định hình cả đời sống thường ngày lẫn các quy trình công nghiệp phức tạp?

Những Phản Ứng Tạo Nhiệt Quanh Ta
Thế giới hóa học đầy rẫy những màn trình diễn năng lượng, và phản ứng tỏa nhiệt chính là những "ngôi sao" sáng giá nhất. Chúng không chỉ diễn ra trong phòng thí nghiệm mà còn hiện diện ngay trong cuộc sống thường ngày của chúng ta, mang đến hơi ấm, ánh sáng và năng lượng.

Một trong những ví dụ kinh điển nhất chính là đốt cháy nhiên liệu. Khi bạn đốt một que củi để sưởi ấm hay bật bếp gas để nấu ăn, đó chính là phản ứng tỏa nhiệt đang hoạt động. Carbon và hydrogen trong nhiên liệu kết hợp với oxy trong không khí, giải phóng một lượng lớn năng lượng dưới dạng nhiệt và ánh sáng rực rỡ. Phản ứng này là nền tảng cho mọi hoạt động từ sưởi ấm, di chuyển (động cơ đốt trong) đến sản xuất điện.
Bạn đã bao giờ cảm thấy cốc nước nóng lên khi cho thêm một chút giấm vào baking soda chưa? Đó là một ví dụ về phản ứng trung hòa axit-bazơ. Khi axit và bazơ gặp nhau, chúng phản ứng để tạo thành muối và nước, đồng thời giải phóng nhiệt ra môi trường xung quanh. Phản ứng này thường được ứng dụng trong y tế (trung hòa axit dạ dày) hoặc trong công nghiệp hóa chất.
Ngay trong cơ thể chúng ta cũng có một phản ứng tỏa nhiệt cực kỳ quan trọng: hô hấp tế bào. Đây là quá trình các tế bào "đốt cháy" glucose (đường) với sự có mặt của oxy để tạo ra năng lượng (ATP) cho mọi hoạt động sống. Phản ứng này cũng sinh ra nhiệt, giúp duy trì thân nhiệt ổn định cho cơ thể. Nó giống như một nhà máy năng lượng tí hon hoạt động không ngừng nghỉ bên trong mỗi chúng ta.
Những ví dụ này chỉ là một phần nhỏ trong vô vàn phản ứng tỏa nhiệt đang diễn ra. Từ việc pháo hoa bùng nổ trên bầu trời đêm đến quá trình đóng rắn của xi măng, tất cả đều minh chứng cho sức mạnh và sự phổ biến của loại phản ứng hóa học thú vị này.
Những Phản Ứng Hút Nhiệt Thường Gặp
Sau khi hiểu phản ứng thu nhiệt là gì, giờ chúng ta cùng điểm qua vài ví dụ quen thuộc để thấy chúng "ăn" năng lượng từ môi trường xung quanh như thế nào nhé.
Một trong những ví dụ kinh điển nhất về phản ứng thu nhiệt chính là quá trình nung đá vôi. Để biến đá vôi (canxi cacbonat) thành vôi sống (canxi oxit) và khí cacbonic, người ta phải đốt lò với nhiệt độ cực cao. Phản ứng này không tự nhiên xảy ra ở điều kiện thường; nó cần một lượng nhiệt khổng lồ từ bên ngoài để phá vỡ các liên kết trong đá vôi. Chính vì thế, đây là một phản ứng thu nhiệt điển hình trong công nghiệp sản xuất vôi.

Xa hơn một chút, hãy nhìn ra vườn cây. Quang hợp – phép màu giúp cây xanh tạo ra thức ăn cho chính mình – cũng là một phản ứng thu nhiệt vĩ đại. Cây xanh hấp thụ năng lượng ánh sáng mặt trời, nước và khí cacbonic để tổng hợp đường (chất hữu cơ) và giải phóng khí oxy. Năng lượng ánh sáng chính là nguồn "nhiệt" (dạng năng lượng) mà phản ứng này "ăn" vào để diễn ra. Không có ánh sáng, quá trình quang hợp sẽ ngừng lại.
Gần gũi hơn nữa, có những phản ứng thu nhiệt lại rất hữu ích trong cuộc sống hàng ngày, ví dụ như khi hòa tan một số loại muối vào nước. Bạn có bao giờ dùng túi chườm lạnh tức thời chưa? Loại túi này hoạt động dựa trên nguyên lý thu nhiệt. Khi bạn bóp túi làm vỡ lớp ngăn cách, một loại muối (thường là amoni nitrat) sẽ hòa tan vào nước. Quá trình hòa tan này "hút" nhiệt từ môi trường xung quanh (chính là vùng da bị chấn thương của bạn), làm cho túi và vùng tiếp xúc trở nên lạnh đi nhanh chóng. Đây là minh chứng rõ ràng cho việc một phản ứng thu nhiệt có thể làm giảm nhiệt độ môi trường.
Phản ứng Hóa học Những Ứng Dụng Quanh Ta
Hóa học không chỉ nằm trong sách vở hay phòng thí nghiệm đâu nhé. Những phản ứng tỏa nhiệt và thu nhiệt mà chúng ta vừa tìm hiểu thực ra lại rất gần gũi, xuất hiện khắp nơi trong cuộc sống và công nghiệp, giúp mọi thứ vận hành trơn tru hơn đấy.
Hãy nhìn vào những phản ứng tỏa nhiệt trước nha. Chúng là "nguồn nhiệt" tuyệt vời! Khi bạn đốt củi sưởi ấm trong ngày đông lạnh giá, hay đốt gas để nấu một bữa cơm ngon, đó chính là lúc phản ứng tỏa nhiệt đang làm việc. Năng lượng được giải phóng ra môi trường dưới dạng nhiệt, giúp tăng nhiệt độ và làm chín thức ăn. Trên quy mô lớn hơn, các nhà máy điện đốt than, dầu mỏ hoặc khí tự nhiên để đun sôi nước, tạo hơi nước làm quay tua-bin phát điện – đây là ứng dụng cực kỳ quan trọng trong sản xuất năng lượng công nghiệp. Phản ứng tỏa nhiệt còn có mặt trong các loại pin, cung cấp năng lượng cho đủ thứ thiết bị từ điện thoại đến xe hơi điện.
Còn phản ứng thu nhiệt thì sao? Dù không phổ biến bằng trong việc tạo ra nhiệt, chúng lại cực kỳ hữu ích khi chúng ta cần làm lạnh hoặc thực hiện các quá trình đòi hỏi năng lượng đầu vào. Ví dụ điển hình nhất có lẽ là chiếc túi chườm lạnh tức thời mà bạn dùng khi bị bong gân hay va đập. Chỉ cần bóp nhẹ cho các hóa chất bên trong tiếp xúc với nhau, một phản ứng thu nhiệt sẽ diễn ra, hấp thụ nhiệt từ môi trường xung quanh (là vùng da bị thương của bạn đấy) và làm nó lạnh đi nhanh chóng. Trong công nghiệp, phản ứng thu nhiệt đóng vai trò quan trọng trong sản xuất nhiều loại vật liệu. Chẳng hạn, quá trình nung vôi để sản xuất xi măng đòi hỏi phải cung cấp một lượng nhiệt lớn để phân hủy đá vôi – đây là một phản ứng thu nhiệt điển hình. Hay việc nấu chảy quặng kim loại để tách lấy kim loại tinh khiết cũng cần năng lượng đầu vào khổng lồ.

Như vậy, dù là giải phóng hay hấp thụ năng lượng, cả phản ứng tỏa nhiệt và thu nhiệt đều là những công cụ mạnh mẽ mà con người đã và đang khai thác để phục vụ cuộc sống, từ những việc đơn giản hàng ngày đến các quy trình công nghiệp phức tạp. Chúng là minh chứng sống động cho thấy hóa học luôn hiện diện và mang lại những lợi ích thiết thực cho chúng ta.
Enthalpy Biến Thiên: Con Số Năng Lượng Phản Ứng
Chúng ta đã thấy phản ứng hóa học có thể "nhả" năng lượng ra ngoài hay "hút" năng lượng vào trong. Nhưng liệu có cách nào để đặt một con số cụ thể cho sự trao đổi năng lượng đó không? Chắc chắn rồi, và đó chính là lúc chúng ta nói về biến thiên enthalpy, ký hiệu là ΔH. Hãy tưởng tượng bạn đang đọc công thức nấu ăn và nó ghi rõ cần bao nhiêu nhiệt độ, bao nhiêu thời gian – ΔH cũng giống như vậy, nó định lượng năng lượng. Khi các nhà khoa học nghiên cứu pin nhiên liệu hay thiết kế lò phản ứng, họ cần biết chính xác ΔH của từng bước. Làm thế nào để họ có được những con số đó, và tại sao đôi khi ΔH lại mang dấu âm, đôi khi lại mang dấu dương?
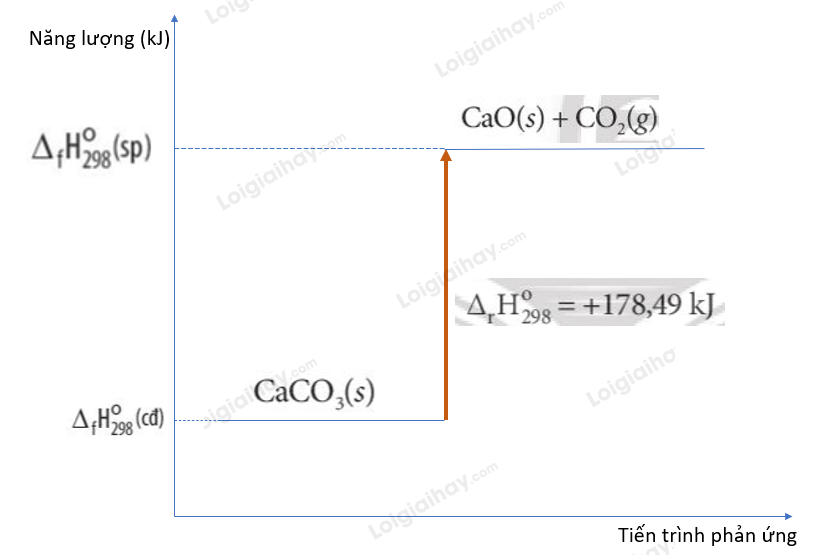
Dấu hiệu năng lượng qua Biến thiên Enthalpy Chuẩn
Khi nói về năng lượng trong phản ứng hóa học, chúng ta cần một thước đo chuẩn để dễ dàng so sánh. Đó chính là lúc "biến thiên enthalpy chuẩn" bước ra ánh sáng. Tưởng tượng bạn đang cân một vật gì đó, bạn cần một cái cân và đơn vị đo lường thống nhất, đúng không? Biến thiên enthalpy chuẩn (ký hiệu là ΔrH⁰₂₉₈) cũng tương tự vậy, nó là thước đo sự thay đổi năng lượng khi phản ứng diễn ra, nhưng được "chuẩn hóa" ở những điều kiện nhất định.

Vậy điều kiện "chuẩn" ở đây là gì? Nó giống như một quy ước quốc tế vậy đó, giúp mọi nhà khoa học trên thế giới đều hiểu và so sánh kết quả với nhau. Cụ thể, điều kiện chuẩn bao gồm:
- Áp suất: 1 bar (gần bằng 1 atm).
- Nồng độ: 1 mol/L đối với các chất tan trong dung dịch.
- Nhiệt độ: 298 Kelvin, tương đương với 25 độ C – nhiệt độ phòng khá thoải mái.
Khi một phản ứng xảy ra dưới những điều kiện "chuẩn" này, sự thay đổi enthalpy của nó được gọi là biến thiên enthalpy chuẩn. Con số này cho chúng ta biết lượng nhiệt (hoặc năng lượng dưới dạng khác) mà hệ phản ứng trao đổi với môi trường xung quanh.
Điều quan trọng nhất cần nắm về biến thiên enthalpy chuẩn chính là dấu của nó. Dấu này như một tín hiệu "mật" cho biết phản ứng đang làm gì với năng lượng:
- Nếu ΔrH⁰₂₉₈ có dấu âm (ΔH < 0): Điều này có nghĩa là hệ phản ứng đã giải phóng năng lượng ra môi trường. Năng lượng này thường thoát ra dưới dạng nhiệt, làm cho môi trường xung quanh nóng lên. Đây chính là đặc trưng của phản ứng tỏa nhiệt. Giống như khi bạn đốt củi, nhiệt lượng tỏa ra làm ấm không khí vậy.
- Nếu ΔrH⁰₂₉₈ có dấu dương (ΔH > 0): Ngược lại, dấu dương cho thấy hệ phản ứng đã hấp thụ năng lượng từ môi trường. Phản ứng này cần "ăn" năng lượng để có thể xảy ra, làm cho môi trường xung quanh lạnh đi (nếu năng lượng hấp thụ là nhiệt). Đây là dấu hiệu của phản ứng thu nhiệt. Tưởng tượng viên đá lạnh tan chảy, nó hút nhiệt từ tay bạn làm tay bạn thấy lạnh.
Tóm lại, chỉ cần nhìn vào dấu của ΔrH⁰₂₉₈, bạn có thể biết ngay phản ứng đó là tỏa nhiệt hay thu nhiệt dưới điều kiện chuẩn. Dấu âm là tỏa, dấu dương là thu – đơn giản và cực kỳ hữu ích phải không nào?
Đọc hiểu phương trình nhiệt hóa học
Phương trình hóa học thông thường chỉ cho chúng ta biết chất nào phản ứng với chất nào để tạo ra sản phẩm gì. Nhưng trong thế giới hóa học, mỗi phản ứng đều đi kèm với sự thay đổi năng lượng. Để thể hiện "ngôn ngữ" năng lượng này, người ta dùng đến một dạng đặc biệt: phương trình nhiệt hóa học.
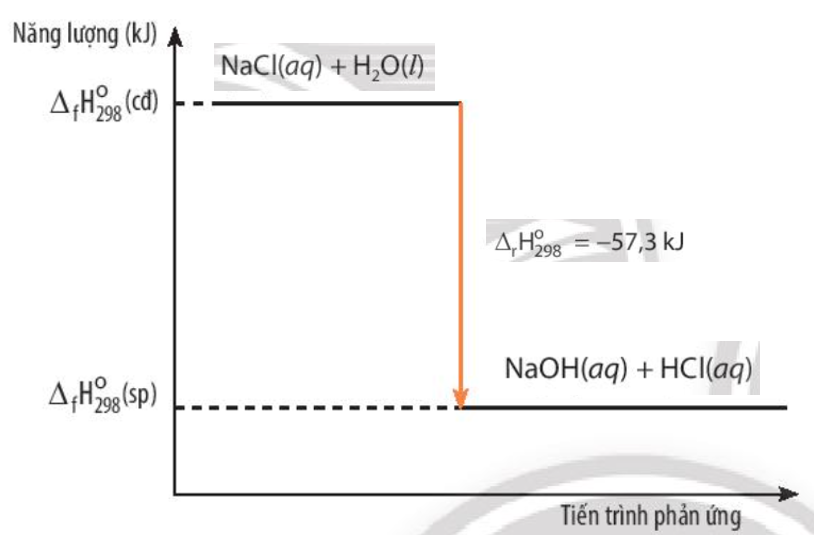
Đây không chỉ đơn thuần là một phương trình cân bằng thông thường. Nó còn cung cấp thêm những thông tin cực kỳ quan trọng, giúp ta hiểu rõ hơn về "dòng chảy" năng lượng trong quá trình phản ứng.
Một phương trình nhiệt hóa học đầy đủ sẽ bao gồm:
- Phương trình hóa học đã cân bằng: Giống như mọi phương trình hóa học khác, nó cho biết tỉ lệ mol của các chất tham gia và sản phẩm.
- Trạng thái vật lý của các chất: Đây là điểm khác biệt quan trọng. Bạn sẽ thấy ký hiệu (s) cho chất rắn, (l) cho chất lỏng, (g) cho chất khí và (aq) cho chất tan trong nước (dung dịch). Việc ghi rõ trạng thái là bắt buộc vì năng lượng liên quan đến phản ứng phụ thuộc rất nhiều vào việc chất đó đang ở dạng rắn, lỏng hay khí. Ví dụ, việc tạo ra nước lỏng sẽ giải phóng năng lượng khác với việc tạo ra hơi nước từ cùng lượng chất ban đầu.
- Giá trị biến thiên enthalpy (ΔH): Đây chính là "trái tim" của phương trình nhiệt hóa học, thể hiện lượng nhiệt được trao đổi với môi trường khi phản ứng diễn ra theo đúng tỉ lệ mol đã ghi trong phương trình. Giá trị ΔH thường được viết ở cuối phương trình, kèm theo dấu và đơn vị (thường là kilojoule, kJ).
Dấu của ΔH nói lên tất cả:
- Nếu ΔH có dấu âm (ΔH < 0), phản ứng đó là tỏa nhiệt. Năng lượng được giải phóng ra môi trường.
- Nếu ΔH có dấu dương (ΔH > 0), phản ứng đó là thu nhiệt. Năng lượng được hấp thụ từ môi trường.
Hãy xem một ví dụ đơn giản: Phản ứng tạo thành nước từ khí hydro và khí oxy.
H₂(g) + ½ O₂(g) → H₂O(l) ΔH = -285.8 kJ
Phương trình này cho ta biết:
- Khi 1 mol khí hydro (H₂) phản ứng hoàn toàn với ½ mol khí oxy (O₂)
- Để tạo ra 1 mol nước ở trạng thái lỏng (H₂O(l))
- Thì 285.8 kJ năng lượng sẽ được giải phóng ra môi trường (vì ΔH mang dấu âm).
Nếu phản ứng tạo ra nước ở trạng thái khí (hơi nước) thì sao?
H₂(g) + ½ O₂(g) → H₂O(g) ΔH = -241.8 kJ
Lúc này, chỉ có 241.8 kJ năng lượng được giải phóng. Sự khác biệt này chính là năng lượng cần thiết để chuyển 1 mol nước từ trạng thái lỏng sang khí (nhiệt hóa hơi). Điều này càng khẳng định tầm quan trọng của việc ghi rõ trạng thái vật lý trong phương trình nhiệt hóa học.
Tóm lại, phương trình nhiệt hóa học là một công cụ mạnh mẽ, không chỉ cho thấy bức tranh "ai với ai" trong phản ứng, mà còn hé lộ câu chuyện về năng lượng đi kèm, giúp chúng ta dự đoán và kiểm soát các quá trình hóa học trong thực tế.
Enthalpy tạo thành chuẩn và cách tính năng lượng phản ứng
Rồi, giờ nói về một cái chỉ số cực kỳ quan trọng giúp chúng ta "đong đếm" năng lượng trong hóa học, đó là enthalpy tạo thành chuẩn, ký hiệu là ΔfH⁰₂₉₈. Hiểu đơn giản, đây là lượng nhiệt tỏa ra hay thu vào khi tạo thành một mol của một chất từ các nguyên tố của nó, tất cả đều ở trạng thái bền vững nhất dưới điều kiện chuẩn (áp suất 1 bar, nhiệt độ 298K hay 25°C). Nó giống như "chi phí năng lượng" để xây dựng nên một phân tử từ những viên gạch nguyên tố vậy.
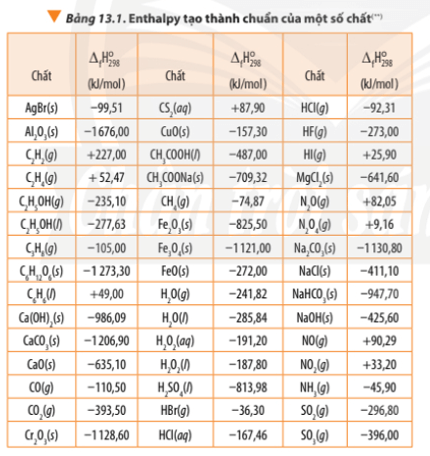
Cái "trạng thái bền vững nhất dưới điều kiện chuẩn" nghe hơi học thuật đúng không? Ví dụ như oxy thì ở trạng thái khí O₂, carbon thì là than chì (graphite), hydro là khí H₂. Đây là những dạng tồn tại tự nhiên, ổn định nhất của chúng ở điều kiện chuẩn. Và vì enthalpy tạo thành chuẩn được định nghĩa là tạo thành từ chính các nguyên tố ở trạng thái chuẩn, nên enthalpy tạo thành chuẩn của các nguyên tố ở trạng thái chuẩn luôn bằng không. Chúng ta lấy đó làm điểm mốc để so sánh.
Vậy chỉ số này có ích gì? À, nó chính là nền tảng để chúng ta tính toán biến thiên enthalpy (ΔH) của bất kỳ phản ứng hóa học nào khác mà không cần phải đo đạc trực tiếp. Thay vì phải làm thí nghiệm cho từng phản ứng, chúng ta chỉ cần biết "chi phí năng lượng" để tạo ra từng chất tham gia và sản phẩm.
Dựa trên một nguyên lý quan trọng trong nhiệt hóa học (mà người ta hay gọi là định luật Hess), biến thiên enthalpy chuẩn của một phản ứng (ΔrH⁰) có thể được tính bằng tổng enthalpy tạo thành chuẩn của sản phẩm trừ đi tổng enthalpy tạo thành chuẩn của chất tham gia. Công thức trông sẽ thế này:
ΔrH⁰ = ΣnΔfH⁰(sản phẩm) - ΣmΔfH⁰(chất tham gia)
Trong đó, n và m là hệ số tỉ lượng tương ứng trong phương trình phản ứng đã cân bằng.
Tóm lại, các giá trị enthalpy tạo thành chuẩn của hàng ngàn chất hóa học đã được các nhà khoa học đo đạc và lập bảng. Chúng giống như một bộ "nguyên liệu" năng lượng có sẵn. Nhờ có chúng và công thức trên, chúng ta có thể dễ dàng dự đoán và tính toán lượng nhiệt tỏa ra hay thu vào của vô số phản ứng, từ đó hiểu rõ hơn về bản chất năng lượng của thế giới hóa học xung quanh ta.
