Hãy nhìn quanh bạn lúc này. Chiếc bàn, quyển sách, không khí bạn đang hít thở, và cả chính cơ thể bạn – tất cả đều được tạo nên từ những hạt vô cùng nhỏ bé. Chúng là những viên gạch xây dựng nên vũ trụ vật chất này, mang trong mình bí mật về hình dạng, tính chất và sự biến đổi của vạn vật. Tưởng tượng một giọt nước nhỏ bé, bên trong nó chứa đựng hàng tỷ, hàng tỷ những đơn vị cơ bản nhất của nước, không ngừng chuyển động và tương tác. Những đơn vị kỳ diệu ấy chính là phân tử. Chúng không chỉ đơn thuần là tập hợp các nguyên tử, mà còn là hạt đại diện cho chất, quyết định mọi đặc tính hóa học mà chúng ta quan sát được. Nhưng phân tử chính xác là gì, và chúng kết hợp với nhau ra sao để tạo nên vũ trụ vật chất đa sắc này?
Phân tử là gì và những điều bạn cần biết
Bạn có bao giờ tự hỏi, mọi thứ xung quanh chúng ta, từ giọt nước trong veo, không khí ta hít thở, đến chiếc bàn, quyển sách, rốt cuộc được tạo nên từ đâu không? Nếu bóc tách mọi vật chất đến tận cùng, chúng ta sẽ chạm tới những "viên gạch" cực kỳ nhỏ bé, mà một trong số đó chính là phân tử.
Đơn giản mà nói, phân tử là hạt nhỏ nhất của một chất mà vẫn giữ nguyên được tính chất hóa học đặc trưng của chất ấy. Hãy tưởng tượng nước (H₂O) đi, dù bạn chia nhỏ đến đâu, miễn là vẫn còn một nhóm gồm hai nguyên tử hydro "ôm" lấy một nguyên tử oxy, nó vẫn là nước và có tính chất của nước. Nếu chia nhỏ hơn nữa, thành từng nguyên tử hydro hay oxy riêng lẻ, thì đó không còn là nước nữa rồi. Phân tử chính là "đại diện" cho chất ở cấp độ vi mô.
Vậy phân tử có những đặc điểm gì thú vị?
Đầu tiên, hầu hết các phân tử đều trung hòa về điện. Tức là, tổng điện tích dương của các hạt nhân nguyên tử bên trong cân bằng với tổng điện tích âm của các electron. Chúng không mang điện tích dương hay âm rõ rệt như ion.
Thứ hai, phân tử cực kỳ, cực kỳ nhỏ bé. Nhỏ đến mức không thể nhìn thấy bằng mắt thường hay thậm chí kính hiển vi thông thường. Chúng chỉ có thể được "nhìn thấy" hoặc nghiên cứu gián tiếp bằng các phương pháp khoa học hiện đại, phức tạp. Để dễ hình dung, một giọt nước nhỏ xíu thôi cũng chứa hàng tỷ tỷ phân tử nước.
Một đặc điểm không thể bỏ qua là phân tử luôn chuyển động không ngừng. Dù ở trạng thái rắn, lỏng hay khí, các phân tử không bao giờ đứng yên. Ở thể rắn, chúng rung động quanh vị trí cố định. Ở thể lỏng, chúng trượt lên nhau. Còn ở thể khí, chúng bay lộn xộn với tốc độ rất nhanh và va chạm liên tục. Chính sự chuyển động này là nguồn gốc của nhiều hiện tượng vật lý và hóa học.
Cuối cùng, và đây là điểm mấu chốt, phân tử có khả năng tồn tại độc lập. Một phân tử nước có thể "lang thang" một mình trong không khí (hơi nước) hoặc trong lòng chất lỏng mà vẫn là phân tử nước. Điều này khác với hầu hết các nguyên tử, chúng thường không tồn tại một mình mà có xu hướng liên kết với nhau để tạo thành phân tử hoặc mạng lưới tinh thể bền vững hơn.
Tóm lại, phân tử là những hạt vô cùng nhỏ, trung hòa về điện, luôn chuyển động và có khả năng tồn tại độc lập, mang đầy đủ tính chất hóa học của chất mà nó cấu tạo nên. Chúng chính là những "người chơi" chính trong thế giới hóa học, tham gia vào mọi phản ứng và tạo nên sự đa dạng của vạn vật.
Nguyên tử bắt tay nhau tạo nên phân tử
Nếu nguyên tử là những viên gạch nhỏ xíu, thì phân tử chính là những ngôi nhà, những công trình phức tạp được xây nên từ chính những viên gạch ấy. Vậy làm sao mà những nguyên tử bé tí lại có thể kết hợp lại với nhau một cách chặt chẽ đến vậy? Bí mật nằm ở "lực hóa trị" – một loại keo dính vô hình nhưng cực kỳ mạnh mẽ giữa các nguyên tử.
Tưởng tượng mỗi nguyên tử có những "cánh tay" hoặc "móc nối" đặc biệt. Khi hai hay nhiều nguyên tử lại gần nhau, những "cánh tay" này sẽ tìm cách kết nối, tạo thành một liên kết bền vững. Quá trình này không phải ngẫu nhiên mà tuân theo những quy tắc nhất định, dựa trên bản chất và số lượng "cánh tay" mà mỗi loại nguyên tử sở hữu. Chính những liên kết này giữ các nguyên tử lại với nhau, tạo nên hình hài và cấu trúc đặc trưng của từng loại phân tử.
Thế giới phân tử muôn màu muôn vẻ lắm! Sự đa dạng này đến từ hai yếu tố chính: số lượng nguyên tử tham gia và loại nguyên tử kết hợp.
Có những phân tử cực kỳ đơn giản, chỉ cần hai anh bạn nguyên tử bắt tay nhau là đủ. Chẳng hạn như khí oxy chúng ta hít thở hàng ngày (O₂), hay khí nitơ chiếm phần lớn không khí (N₂). Đôi khi, hai nguyên tử này lại là hai loại khác nhau, như phân tử khí hydro clorua (HCl) hay khí carbon monoxide (CO). Chúng được gọi là phân tử hai nguyên tử.
Nhưng cuộc sống phân tử đa dạng hơn nhiều! Phần lớn các chất quen thuộc lại được tạo thành từ những phân tử "đông dân" hơn, gồm ba, bốn, hay thậm chí hàng chục, hàng trăm nguyên tử cùng "chung nhà". Đó là những phân tử đa nguyên tử. Nước (H₂O) là một ví dụ điển hình với ba nguyên tử (một oxy và hai hydro). Khí carbon dioxide (CO₂) có ba nguyên tử (một carbon và hai oxy). Đường ăn (sucrose – C₁₂H₂₂O₁₁) thì phức tạp hơn nhiều với tổng cộng 45 nguyên tử! Số lượng và cách sắp xếp các nguyên tử này quyết định hoàn toàn tính chất của chất đó.
Và còn có những "gã khổng lồ" trong thế giới phân tử – đó là các polymer. Thay vì chỉ vài chục hay vài trăm nguyên tử, polymer là những chuỗi dài vô tận được tạo thành từ việc lặp đi lặp lại của những đơn vị nhỏ hơn (gọi là monomer). Tưởng tượng như xâu chuỗi hạt, mỗi hạt là một monomer và cả sợi dây dài là một polymer. Nhựa mà chúng ta dùng hàng ngày, sợi bông trong quần áo, hay thậm chí DNA mang thông tin di truyền trong cơ thể chúng ta đều là những ví dụ về polymer. Sự hình thành liên kết và cấu trúc phức tạp này chính là nền tảng tạo nên sự đa dạng và phong phú của thế giới vật chất xung quanh chúng ta.
Thế giới Phân tử đa dạng Đơn chất và Hợp chất
Thế giới quanh ta muôn màu muôn vẻ, từ viên kim cương lấp lánh đến giọt nước trong veo, hay bầu không khí ta hít thở. Sự khác biệt ấy không chỉ nằm ở cách các phân tử sắp xếp hay chuyển động, mà còn ở chính "thành phần" tạo nên chúng. Tưởng tượng như một bộ xếp hình khổng lồ, chỉ cần thay đổi loại gạch (nguyên tử) hoặc cách ghép (liên kết), ta sẽ tạo ra những hình dạng (phân tử) hoàn toàn mới với tính chất riêng biệt. Chính sự đa dạng về thành phần nguyên tử này đã chia thế giới phân tử thành hai "gia tộc" lớn: đơn chất và hợp chất. Vậy, đâu là điểm khác biệt cốt lõi giữa "gia tộc" chỉ dùng một loại gạch và "gia tộc" kết hợp nhiều loại gạch khác nhau?
Đơn chất Chỉ Cần Một Loại Nguyên Tử
Trong thế giới phân tử muôn hình vạn trạng, không phải lúc nào chúng cũng là sự kết hợp phức tạp của đủ loại nguyên tử khác nhau. Đôi khi, sự đơn giản lại tạo nên những chất cực kỳ quan trọng. Đó là câu chuyện của các phân tử đơn chất.
Tưởng tượng một đội bóng mà tất cả cầu thủ đều đến từ cùng một gia đình. Phân tử đơn chất cũng vậy, chúng chỉ được tạo nên từ các nguyên tử cùng một nguyên tố hóa học. Dù chỉ có một "nguyên liệu" duy nhất, nhưng cách các nguyên tử này liên kết với nhau lại tạo ra những chất có tính chất rất riêng biệt.
Lấy ví dụ quen thuộc nhất, khí oxi mà chúng ta hít thở hàng ngày không phải là nguyên tử oxi đứng một mình. Nó tồn tại dưới dạng phân tử gồm hai nguyên tử oxi liên kết chặt chẽ với nhau, ký hiệu là O₂. Tương tự, phần lớn không khí chúng ta đang sống là khí nitơ, được tạo thành từ hai nguyên tử nitơ nối lại, ký hiệu là N₂. Hydro (H₂) hay clo (Cl₂) cũng là những ví dụ điển hình cho kiểu phân tử "hai người" này.
Nhưng không phải lúc nào phân tử đơn chất cũng chỉ có hai nguyên tử. Có những nguyên tố "thích" tụ tập đông hơn. Chẳng hạn, phốt pho trắng tồn tại dưới dạng phân tử có tới bốn nguyên tử phốt pho liên kết với nhau (P₄). Lưu huỳnh thì còn "đông vui" hơn nữa, thường tạo thành phân tử có hình vòng gồm tám nguyên tử lưu huỳnh (S₈).
Điều thú vị là, ngay cả khi được tạo thành từ cùng một loại nguyên tử, cách chúng liên kết và số lượng nguyên tử trong phân tử có thể ảnh hưởng lớn đến trạng thái vật lý của chất ở điều kiện thường. O₂, N₂, H₂, Cl₂ là khí. Brom (Br₂) cũng là đơn chất hai nguyên tử, nhưng lại là chất lỏng. Còn iot (I₂) hay lưu huỳnh (S₈) lại là chất rắn. Sự khác biệt này cho thấy cấu trúc phân tử, dù đơn giản hay phức tạp, đều đóng vai trò then chốt trong việc quyết định tính chất của vật chất.

Phân Tử Hợp Chất Sự Kết Hợp Đa Dạng
Nếu phân tử đơn chất chỉ là "sân chơi" của một loại nguyên tử, thì phân tử hợp chất lại là nơi các nguyên tử khác nhau "bắt tay" lại. Tưởng tượng như bạn đang xây nhà với nhiều loại gạch màu sắc khác nhau vậy đó. Phân tử hợp chất được tạo thành từ nguyên tử của hai hay nhiều nguyên tố khác loại liên kết với nhau.
Điểm đặc biệt và quan trọng nhất là sự kết hợp này không hề ngẫu nhiên. Chúng phải tuân theo một "công thức" nhất định, một tỷ lệ cố định. Chính cái tỷ lệ "chuẩn chỉnh" này tạo nên bản sắc riêng biệt cho từng loại hợp chất, khiến chúng có tính chất hoàn toàn khác với các nguyên tố ban đầu.
Hãy nhìn quanh chúng ta để thấy sự hiện diện của chúng nhé.
Ví dụ điển hình nhất? Nước! Thứ mà chúng ta uống mỗi ngày, tắm rửa, tưới cây… Một phân tử nước được tạo nên từ hai nguyên tử Hydro và một nguyên tử Oxy. Tỷ lệ 2:1 này luôn đúng, tạo nên chất lỏng kỳ diệu, không màu, không mùi, không vị này. Công thức hóa học quen thuộc là H₂O.
Hay khí Carbon Dioxide, CO₂. Chúng ta thở ra nó, cây cối hít vào nó để sống và tạo ra oxy. Một nguyên tử Carbon "kết đôi" với hai nguyên tử Oxy. Công thức 1:2 này tạo ra một loại khí hoàn toàn khác với than chì (Carbon) hay khí Oxy mà ta hít thở.
Rồi muối ăn, thứ gia vị không thể thiếu trong bếp nhà bạn. Tên hóa học của nó là Natri Clorua, NaCl. Một nguyên tử Natri "gắn kết" với một nguyên tử Clo theo tỷ lệ 1:1. Sự kết hợp này tạo ra những tinh thể muối mặn mòi, khác xa kim loại Natri mềm, dễ phản ứng và khí Clo độc hại.
Chính nhờ sự kết hợp theo tỷ lệ "chuẩn chỉnh" này mà các phân tử hợp chất có tính chất riêng biệt, khác hẳn với các nguyên tố tạo ra chúng. Chúng là những "viên gạch" đa dạng, xây nên thế giới vật chất phong phú mà ta thấy, từ không khí, nước uống đến đồ ăn và mọi thứ xung quanh.
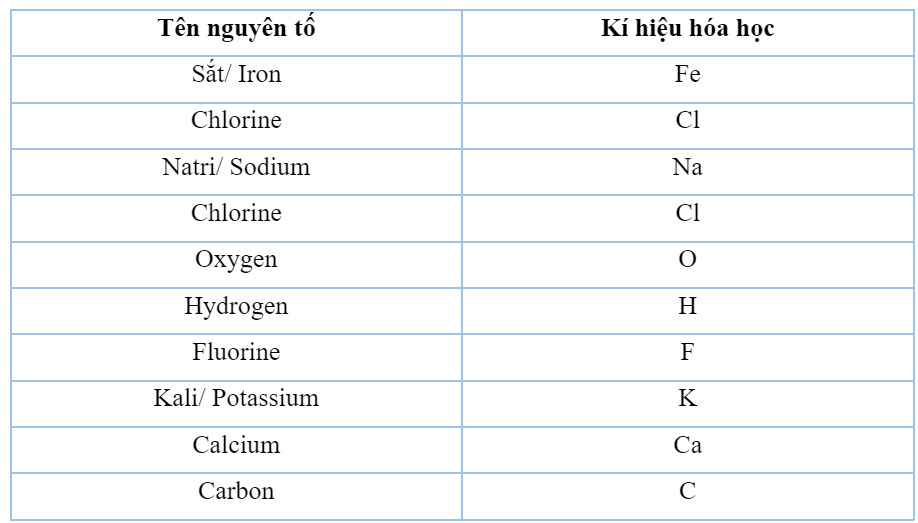
Phân tử khối: Con số nói lên điều gì?
Mỗi phân tử, dù nhỏ bé đến đâu, cũng mang trong mình một "sức nặng" nhất định. Giống như khi bạn cân một quả táo hay một viên bi, các nhà khoa học cũng cần một cách để đo lường khối lượng của những hạt cực nhỏ này. Đó chính là lúc khái niệm phân tử khối xuất hiện.
Đơn giản mà nói, phân tử khối chính là tổng khối lượng của tất cả các nguyên tử tạo nên phân tử đó. Tưởng tượng một phân tử nước (H₂O) nhé. Nó được tạo thành từ hai nguyên tử hydro (H) và một nguyên tử oxi (O). Để biết phân tử nước nặng bao nhiêu, ta chỉ việc cộng khối lượng của hai nguyên tử hydro và một nguyên tử oxi lại.
Đơn vị dùng để đo lường khối lượng nguyên tử hay phân tử là amu (atomic mass unit), hay còn gọi là đơn vị khối lượng nguyên tử. Đây là một đơn vị rất nhỏ, được quy ước dựa trên nguyên tử carbon-12.
Vậy làm sao để tính phân tử khối? Nó đơn giản lắm! Bạn chỉ cần biết công thức hóa học của phân tử và khối lượng nguyên tử của từng nguyên tố có trong đó.
Ví dụ:
- Phân tử nước (H₂O): Có 2 nguyên tử H (khối lượng nguyên tử xấp xỉ 1 amu) và 1 nguyên tử O (khối lượng nguyên tử xấp xỉ 16 amu).
Phân tử khối của H₂O = (2 x khối lượng H) + (1 x khối lượng O)
= (2 x 1) + (1 x 16) = 2 + 16 = 18 amu. - Phân tử khí carbon dioxide (CO₂): Có 1 nguyên tử C (khối lượng nguyên tử xấp xỉ 12 amu) và 2 nguyên tử O (khối lượng nguyên tử xấp xấp xỉ 16 amu).
Phân tử khối của CO₂ = (1 x khối lượng C) + (2 x khối lượng O)
= (1 x 12) + (2 x 16) = 12 + 32 = 44 amu.
Cái con số phân tử khối này cực kỳ quan trọng trong hóa học. Nó giúp chúng ta biết được tỷ lệ khối lượng của các chất khi chúng tham gia phản ứng. Hơn nữa, nó còn là cầu nối để chuyển đổi giữa thế giới siêu nhỏ của nguyên tử, phân tử (đo bằng amu) và thế giới thực mà chúng ta cân đong đo đếm hàng ngày (đo bằng gam).

Chính từ phân tử khối mà người ta đưa ra khái niệm mol và hằng số Avogadro (khoảng 6.022 x 10²³). Một mol bất kỳ chất nào đều chứa một lượng hạt (nguyên tử, phân tử, ion…) bằng hằng số Avogadro. Và điều kỳ diệu là, khối lượng của một mol chất (tính bằng gam) lại có giá trị bằng chính phân tử khối của chất đó (tính bằng amu). Ví dụ, 1 mol nước nặng xấp xỉ 18 gam, 1 mol CO₂ nặng xấp xỉ 44 gam. Nhờ mối liên hệ này, các nhà hóa học có thể dễ dàng tính toán lượng chất cần dùng trong các thí nghiệm hay quy trình sản xuất.
Nguyên Tử, Phân Tử Khác Biệt Nhỏ, Tầm Quan Trọng Lớn
Sau khi đã cùng nhau "giải mã" phân tử là gì, hẳn bạn đang thắc mắc vậy phân tử khác gì với "người anh em" nguyên tử của nó? Hay tại sao chúng ta lại cần phân biệt rạch ròi hai khái niệm này? Chẳng hạn, ai cũng biết nước là H₂O, nhưng liệu bạn có biết rằng nguyên tử Hydro (H) và Oxy (O) khi đứng riêng lẻ lại có tính chất hoàn toàn khác, thậm chí là nguy hiểm? Chính cách chúng liên kết lại thành phân tử nước mới tạo nên sự sống. Vậy sự khác biệt tưởng chừng nhỏ bé giữa nguyên tử và phân tử này lại mang ý nghĩa to lớn như thế nào, không chỉ trong phòng thí nghiệm mà còn ngay trong cuộc sống quanh ta?
Nguyên tử và Phân tử Từ Viên Gạch Đến Công Trình
Hãy tưởng tượng thế giới vật chất như một tòa nhà khổng lồ. Để xây nên tòa nhà ấy, chúng ta cần những viên gạch nhỏ nhất, không thể chia nhỏ hơn bằng phương pháp hóa học thông thường. Đó chính là nguyên tử. Nguyên tử là hạt cơ bản nhất của một nguyên tố hóa học, mang đầy đủ tính chất hóa học của nguyên tố đó. Mỗi loại nguyên tố, từ Hydro nhẹ nhàng đến Vàng quý giá, đều được tạo nên từ những nguyên tử đặc trưng riêng biệt về cấu tạo (số proton, neutron, electron).
Nhưng những viên gạch nguyên tử này hiếm khi đứng một mình trong tự nhiên (trừ mấy anh chàng "khó tính" như khí hiếm). Chúng có xu hướng kết hợp lại với nhau bằng những "chất kết dính" gọi là liên kết hóa học. Khi hai hay nhiều nguyên tử liên kết lại theo một tỷ lệ và cấu trúc xác định, chúng tạo thành phân tử. Phân tử giống như những "khối lắp ghép" hoặc "các bộ phận" lớn hơn được tạo nên từ các viên gạch nguyên tử.
Sự khác biệt cốt lõi nằm ở đây:
- Nguyên tử là đơn vị cơ bản của nguyên tố. Nó thể hiện tính chất của nguyên tố ở cấp độ vi mô nhất.
- Phân tử là đơn vị cơ bản của chất (đơn chất hoặc hợp chất). Nó thể hiện đầy đủ tính chất hóa học của chất đó.
Ví dụ, một nguyên tử oxy (O) rất hoạt động và dễ dàng kết hợp với thứ khác. Nó không có tính chất của khí oxy mà chúng ta hít thở. Nhưng khi hai nguyên tử oxy liên kết lại thành phân tử oxy (O₂), chúng ta có một chất khí duy trì sự sống. Tương tự, nguyên tử hydro (H) và nguyên tử oxy (O) riêng lẻ không phải là nước. Chỉ khi hai nguyên tử hydro kết hợp với một nguyên tử oxy tạo thành phân tử nước (H₂O), chúng ta mới có chất lỏng kỳ diệu mà chúng ta uống hàng ngày.
Về khả năng tồn tại độc lập: Nguyên tử thường không tồn tại độc lập trong điều kiện bình thường (trừ khí hiếm). Chúng vội vã tìm cách liên kết để đạt trạng thái bền vững hơn. Ngược lại, phân tử có thể tồn tại độc lập và giữ nguyên tính chất của chất đó. Một giọt nước chứa vô số phân tử H₂O riêng lẻ, mỗi phân tử đều mang tính chất của nước.
Trong các phản ứng hóa học, nguyên tử và phân tử tham gia ở các cấp độ khác nhau. Phản ứng hóa học thực chất là quá trình phá vỡ các liên kết cũ trong phân tử ban đầu và hình thành các liên kết mới giữa các nguyên tử để tạo ra các phân tử sản phẩm mới. Nguyên tử là những "người chơi" được sắp xếp lại, còn phân tử là những "đội hình" được thay đổi.
Tóm lại, nguyên tử là nền tảng, là viên gạch. Phân tử là cấu trúc được xây dựng từ những viên gạch đó. Hiểu rõ mối quan hệ "xây dựng" này giúp chúng ta giải mã cách thế giới vật chất được tạo nên từ những hạt vô cùng nhỏ bé.
Phân tử: Chìa Khóa Mở Cánh Cửa Khoa Học và Đời Sống
Nếu ví nguyên tử như những viên gạch xây nên vũ trụ, thì phân tử chính là những ngôi nhà, những công trình phức tạp được dựng nên từ những viên gạch ấy. Hiểu về phân tử không chỉ là chuyện của các nhà khoa học trong phòng thí nghiệm, mà nó còn mở ra cả một thế giới kiến thức, ảnh hưởng trực tiếp đến cuộc sống thường ngày của chúng ta, từ những điều nhỏ nhặt nhất đến những vấn đề vĩ mô.
Trong hóa học, phân tử là nhân vật chính. Mọi phản ứng, mọi sự biến đổi của chất đều xoay quanh việc các phân tử tương tác, phá vỡ liên kết cũ và hình thành liên kết mới. Nắm vững cấu trúc, tính chất và cách các phân tử hành xử giúp chúng ta giải thích tại sao nước lại lỏng ở nhiệt độ phòng, tại sao sắt lại gỉ hay làm thế nào để tạo ra nhựa dẻo. Nó là nền tảng để phát triển thuốc men, vật liệu mới, hay đơn giản là hiểu cách nấu ăn.
Không chỉ hóa học, phân tử còn đóng vai trò cực kỳ quan trọng trong vật lý. Trạng thái vật chất (rắn, lỏng, khí) được quyết định bởi cách các phân tử sắp xếp và chuyển động. Nhiệt độ, áp suất, âm thanh, ánh sáng – tất cả đều có thể được giải thích sâu sắc hơn khi nhìn từ góc độ tương tác phân tử.
Nhìn rộng hơn, sang lĩnh vực sinh học, phân tử lại càng hiển hiện sức mạnh của mình. Sự sống, với muôn vàn phức tạp, được xây dựng từ những phân tử khổng lồ như DNA (mang mã di truyền), protein (thực hiện hầu hết các chức năng trong cơ thể), carbohydrate (nguồn năng lượng) và lipid (cấu tạo màng tế bào). Hiểu về các phân tử sinh học là chìa khóa để giải mã cơ chế bệnh tật, phát triển công nghệ sinh học, hay thậm chí là tìm hiểu nguồn gốc sự sống.
Ngay cả trong giáo dục phổ thông, việc học về phân tử là bước đi đầu tiên để các bạn trẻ làm quen với thế giới khoa học tự nhiên. Nó giúp hình thành tư duy logic, khả năng quan sát và giải thích các hiện tượng xung quanh một cách khoa học.
Từ những vật liệu ta chạm vào mỗi ngày như quần áo, đồ nhựa, kim loại, cho đến không khí ta hít thở, nước ta uống, hay thức ăn ta ăn – tất cả đều là tập hợp của vô vàn phân tử. Các quá trình tự nhiên như quang hợp ở cây xanh, sự tuần hoàn của nước, hay chu trình carbon trong khí quyển đều là kết quả của các phản ứng và tương tác ở cấp độ phân tử.

Tóm lại, việc nghiên cứu và hiểu biết về phân tử không chỉ bó hẹp trong phòng thí nghiệm hay sách vở. Nó là nền tảng của hầu hết các ngành khoa học hiện đại và là chìa khóa để chúng ta hiểu sâu sắc hơn về thế giới vật chất và sự sống đang diễn ra quanh mình.
