Tưởng tượng các nguyên tử đang "đổi vai" trong một vở kịch hóa học. Một "diễn viên" mới bước vào và "thế chỗ" một "diễn viên" khác trong một phân tử. Nghe đơn giản vậy thôi, nhưng đây lại là một trong những "vở kịch" cơ bản và quan trọng nhất trong thế giới hóa học, gọi là phản ứng thế. Nó xuất hiện từ những thí nghiệm quen thuộc trong phòng lab, như khi bạn thấy kim loại kẽm "thế chỗ" hydro trong axit để tạo ra khí, cho đến vô vàn phản ứng phức tạp trong tự nhiên và công nghiệp. Vậy, phản ứng thế này có những "vai diễn" (phân loại) nào? Chúng ta sẽ gặp những "tình huống" (ví dụ) nào? Và làm sao để "đóng vai" (giải bài tập) thành thạo loại phản ứng này?
Phản ứng thế là gì
Trong thế giới hóa học muôn màu, có một kiểu phản ứng cực kỳ phổ biến, cứ như một màn "đổi vai" vậy. Đó chính là phản ứng thế. Đơn giản mà nói, phản ứng thế là khi một nguyên tử hoặc một nhóm nguyên tử trong một hợp chất bị "đá văng" ra và được thay thế bằng một nguyên tử của một đơn chất khác.

Tưởng tượng bạn có một đội bóng (hợp chất BX), và một cầu thủ dự bị (đơn chất A) vào sân thay cho một cầu thủ đang đá chính (nguyên tử B). Kết quả là bạn có một đội bóng mới với sự góp mặt của cầu thủ dự bị (hợp chất AX) và cầu thủ bị thay ra đứng ngoài sân (đơn chất B).
Công thức "tổng quát" cho kiểu phản ứng này trông khá đơn giản:
A + BX → AX + B
Ở đây, ‘A’ là nguyên tử của đơn chất, còn ‘BX’ là hợp chất. Sau phản ứng, ‘A’ đã thế chỗ của ‘B’ trong hợp chất, tạo ra ‘AX’ và ‘B’ bị đẩy ra ngoài dưới dạng đơn chất.
Vậy bản chất sâu xa của phản ứng thế là gì? Nó không chỉ đơn thuần là "thay người" trên sân đấu hóa học đâu nhé. Quá trình này thực chất là sự phá vỡ liên kết cũ (giữa B và X) và hình thành liên kết mới (giữa A và X). Điều quan trọng cần nhớ là: không có nguyên tử nào bị mất đi hay thêm vào từ "trên trời rơi xuống", chỉ là chúng đổi chỗ cho nhau một cách "có chiến lược".
Sự "thay chỗ" này xảy ra là do nguyên tử của đơn chất (A) có khả năng phản ứng mạnh hơn hoặc tạo liên kết bền vững hơn với X so với nguyên tử (hoặc nhóm nguyên tử) ban đầu (B).
Một ví dụ "kinh điển" dễ hình dung là khi bạn cho kim loại Kẽm (Zn) vào dung dịch axit clohidric (HCl). Zn sẽ "thế chỗ" của Hydro (H) trong HCl để tạo thành Kẽm clorua (ZnCl₂) và giải phóng khí Hydro (H₂).
Zn + 2HCl → ZnCl₂ + H₂
Trong ví dụ này, Zn là ‘A’, HCl là ‘BX’ (với H là ‘B’ và Cl là ‘X’). Kết quả là ZnCl₂ (‘AX’) và H₂ (‘B’). Phản ứng thế là nền tảng cho rất nhiều quá trình hóa học, từ những thí nghiệm đơn giản trong phòng lab đến các ứng dụng phức tạp trong công nghiệp và đời sống.
Khi Kim Loại Và Phi Kim Đổi Chỗ
Trong thế giới hóa vô cơ đầy màu sắc, phản ứng thế là chuyện thường ngày ở huyện. Nó vẫn giữ nguyên bản chất cốt lõi: một nguyên tử hay nhóm nguyên tử trong hợp chất bị "đá" ra ngoài để nhường chỗ cho một nguyên tử của đơn chất nhảy vào. Nhưng ở đây, câu chuyện có thêm những gia vị đặc biệt, gắn liền với sức mạnh và vị thế của các nguyên tố.

Điều làm nên nét riêng của phản ứng thế vô cơ chính là sự thay đổi số oxi hóa. Đây thực chất là một dạng phản ứng oxi hóa-khử. Nguyên tử đơn chất tham gia phản ứng thường đóng vai trò chất khử hoặc chất oxi hóa, còn nguyên tử bị thế trong hợp chất thì ngược lại. Màn đổi chỗ này chỉ xảy ra khi nguyên tố đơn chất đủ "mạnh" để đẩy nguyên tố trong hợp chất ra.
Ai sẽ là người thắng cuộc trong màn đổi chỗ này? Bí quyết nằm ở dãy hoạt động hóa học. Cái "dãy" này giống như bảng xếp hạng sức mạnh vậy đó. Kim loại đứng trước thì mạnh hơn, dễ dàng "thế" kim loại đứng sau ra khỏi dung dịch muối hay axit của nó. Phi kim cũng có "sức mạnh" tương đối để thế chỗ nhau trong một số trường hợp đặc biệt. Hiểu rõ thứ tự trong dãy hoạt động là chìa khóa để dự đoán liệu phản ứng thế vô cơ có xảy ra hay không.
Hãy xem vài ví dụ cụ thể để thấy rõ hơn nhé.

Kim loại "đá" Hydro ra khỏi axit
Bạn thả một miếng kẽm (Zn) vào dung dịch axit clohidric (HCl). Kẽm đứng trước Hydro trong dãy hoạt động kim loại, nghĩa là nó "mạnh" hơn Hydro. Thế là kẽm hiên ngang đẩy Hydro ra khỏi HCl để chiếm lấy gốc Clorua, tạo thành kẽm clorua (ZnCl₂) và khí Hydro (H₂) sủi bọt bay lên.
Zn + 2HCl → ZnCl₂ + H₂
Trong phản ứng này, kẽm từ số oxi hóa 0 tăng lên +2, còn Hydro từ +1 giảm xuống 0. Rõ ràng có sự thay đổi số oxi hóa.
Kim loại "đá" kim loại khác ra khỏi muối
Thử thả một sợi dây đồng (Cu) vào dung dịch bạc nitrat (AgNO₃). Đồng đứng trước Bạc (Ag) trong dãy hoạt động. Thế là Đồng lại thể hiện sức mạnh, đẩy Bạc ra khỏi dung dịch muối của nó. Bạn sẽ thấy lớp bạc trắng lấp lánh bám lên sợi dây đồng, còn dung dịch ban đầu không màu dần chuyển sang màu xanh đặc trưng của muối đồng(II) nitrat.
Cu + 2AgNO₃ → Cu(NO₃)₂ + 2Ag
Ở đây, Đồng từ số oxi hóa 0 lên +2, còn Bạc từ +1 xuống 0. Lại là màn đổi vai kèm theo sự thay đổi số oxi hóa.
Phi kim "cướp" kim loại từ oxit
Đôi khi, phi kim cũng tham gia vào cuộc chơi thế chỗ này, đặc biệt là trong các phản ứng cần nhiệt độ cao. Ví dụ điển hình là quá trình luyện kim, dùng Carbon (than cốc) để khử oxit kim loại. Khi nung nóng than chì (Carbon – C) với đồng(II) oxit (CuO), Carbon hoạt động như một chất khử mạnh. Nó sẽ "cướp" lấy Oxi từ CuO, giải phóng kim loại Đồng.
C + 2CuO → 2Cu + CO₂
Trong phản ứng này, Carbon từ số oxi hóa 0 tăng lên +4, còn Đồng từ +2 giảm xuống 0. Đây là một dạng phản ứng thế Carbon cho Đồng trong hợp chất oxit, dưới góc độ oxi hóa khử.
Tóm lại, phản ứng thế trong hóa vô cơ chủ yếu xoay quanh cuộc chiến giành giật vị trí dựa trên sức mạnh hoạt động của các nguyên tố, luôn đi kèm với sự thay đổi số oxi hóa. Hiểu rõ dãy hoạt động hóa học là chìa khóa để "đọc vị" những phản ứng này.
Nãy giờ mình đã lượn qua thế giới vô cơ với những màn "thay người" khá thẳng thắn rồi nhỉ? Giờ thì rẽ sang một sân chơi hoàn toàn khác, nơi mọi thứ có vẻ "lắt léo" và đa dạng hơn nhiều: Hóa hữu cơ. Phản ứng thế ở đây không chỉ đơn giản là "ông này ra, ông kia vào" như kim loại đẩy nhau đâu. Nó có đủ "chiêu trò", từ những pha "tấn công" bất ngờ của các tác nhân thân hạch, sự "thay người" trên vòng thơm đặc trưng, cho đến những cơ chế gốc tự do "điên cuồng" dưới ánh sáng. Tưởng tượng xem, việc biến dầu mỏ thành nhựa, hay tổng hợp thuốc men phức tạp như paracetamol, đều có bóng dáng của phản ứng thế hữu cơ. Như câu nói vui trong giới hóa học: "Muốn đổi mới, phải biết thế!". Vậy, điều gì làm cho phản ứng thế trong hữu cơ lại phong phú và "khó đoán" đến vậy, và chúng diễn ra theo những "kịch bản" nào?
Thế Hạt Nhân SN Phản Ứng Đa Dạng
Hóa hữu cơ có muôn vàn phản ứng hay ho, và "thế ái lực hạt nhân" hay gọi tắt là SN là một trong số đó. Nghe tên có vẻ hơi "khoa học" nhỉ? Nhưng thực ra, nó mô tả một quá trình khá đơn giản: một anh chàng giàu electron (gọi là tác nhân thân hạch) đến đá văng một nhóm khác ra khỏi phân tử, và thế chỗ vào đó.
Tưởng tượng phân tử hữu cơ của chúng ta như một "ngôi nhà" có một "cánh cửa" (liên kết) và một "người ở" (nhóm xuất). Tác nhân thân hạch chính là "vị khách" muốn vào nhà. Vị khách này "thân" với hạt nhân, tức là thích những chỗ thiếu electron, thường là nguyên tử carbon mang một phần điện tích dương do liên kết với nguyên tử âm điện hơn (như halogen).
Còn "người ở" kia, nhóm xuất, phải là người "dễ tính", sẵn sàng rời đi để nhường chỗ cho vị khách mới. Nhóm xuất tốt thường là những ion hoặc phân tử trung hòa, bền vững sau khi tách ra, ví dụ như các ion halogenua (Cl⁻, Br⁻, I⁻) hay nhóm tosylate.
Tuy cùng là "thế chỗ", nhưng quá trình này có thể diễn ra theo hai "kịch bản" chính, hai cơ chế khác nhau hoàn toàn: SN1 và SN2.
Cơ chế SN2: Nhanh Gọn Một Bước
Cơ chế SN2 thì nhanh gọn hơn, chỉ diễn ra trong một bước duy nhất. Vị khách (tác nhân thân hạch) không chờ người ở cũ đi hẳn rồi mới vào. Anh ta "tấn công" thẳng vào "ngôi nhà" từ phía đối diện với người sắp đi.
Hãy hình dung cảnh này: vị khách đang chen vào, người ở cũ đang chuẩn bị bước ra, tất cả diễn ra cùng lúc, tạo thành một trạng thái "lưng chừng" không bền vững gọi là trạng thái chuyển tiếp. Trong trạng thái này, carbon trung tâm tạm thời liên kết với cả tác nhân thân hạch mới và nhóm xuất cũ.
Điều đặc biệt là vì tấn công từ phía sau, cấu hình không gian của phân tử sẽ bị "lật ngược" lại, giống như chiếc ô bị gió thổi lật vậy. Nếu phân tử ban đầu có tâm bất đối, sản phẩm tạo thành sẽ có cấu hình ngược lại hoàn toàn so với chất phản ứng. Phản ứng SN2 thường xảy ra mạnh mẽ nhất với các carbon ít bị án ngữ không gian (như carbon bậc 1 hoặc methyl) vì không gian chật chội sẽ cản trở "vị khách" tấn công từ phía sau.

Cơ chế SN1: Từ Tốn Hai Bước
Cơ chế SN1 thì "từ tốn" hơn, chia làm hai bước. Bước đầu tiên, "người ở" (nhóm xuất) tự động "bỏ nhà đi" trước. Bước này thường diễn ra chậm và quyết định tốc độ của toàn bộ phản ứng. Lúc này, "ngôi nhà" (phần còn lại của phân tử) bị mất đi một phần, trở thành một cấu trúc không bền gọi là carbocation. Carbocation này giống như một "khoảng trống" phẳng lì, mang điện tích dương trên nguyên tử carbon.
Bước thứ hai mới là lúc "vị khách" (tác nhân thân hạch) đến. Vì carbocation phẳng, vị khách có thể tấn công từ cả hai phía: phía trước hoặc phía sau khoảng trống đó. Kết quả là chúng ta có thể thu được cả hai dạng đồng phân không gian (nếu phân tử ban đầu có tâm bất đối) với tỷ lệ gần bằng nhau. Nói cách khác, cấu hình không gian bị "pha loãng", không còn giữ nguyên hoặc bị lật hoàn toàn nữa, hiện tượng này gọi là racemization.

Phản ứng SN1 thường ưa chuộng các carbon tạo ra carbocation bền vững hơn, thường là carbon bậc 3, bậc 2, hoặc carbon liên kết với vòng thơm (benzyl) hay liên kết đôi (allyl), vì carbocation càng bền thì bước đầu tiên càng dễ xảy ra.
Vậy điểm khác biệt cốt lõi là gì? SN2 một bước, SN1 hai bước qua carbocation. SN2 lật ngược cấu hình, SN1 thì tạo hỗn hợp đồng phân không gian. Hiểu rõ hai cơ chế này giúp chúng ta dự đoán sản phẩm và điều kiện phản ứng phù hợp trong hóa hữu cơ.
Thế Ái Lực Điện Tử Kẻ Thích Electron
Bạn có bao giờ nghe đến "kẻ thích electron" chưa? Trong hóa học, chúng ta gọi đó là tác nhân thân điện tử, hay electrophile. Tưởng tượng chúng là những anh chàng hoặc cô nàng đang "đói" electron, luôn tìm kiếm những vùng giàu electron để "tấn công". Phản ứng thế ái lực điện tử, viết tắt là SE (Electrophilic Substitution), chính là sân chơi của những kẻ thích electron này.
Bản chất của phản ứng SE là tác nhân thân điện tử sẽ lao vào một phân tử, đá văng một nguyên tử hay nhóm nguyên tử khác (thường là nguyên tử hydro) để chiếm chỗ. Nghe có vẻ hơi bạo lực, nhưng đó là cách các nguyên tử sắp xếp lại vị trí của mình để tạo ra những hợp chất mới toanh đấy.
Sân khấu quen thuộc nhất cho phản ứng SE chính là vòng thơm, mà điển hình là vòng benzen. Tại sao lại là vòng benzen? À, bởi vì vòng benzen có hệ thống electron pi liên hợp rất đặc biệt, tạo nên một "đám mây" electron dày đặc, cực kỳ hấp dẫn đối với những tác nhân thân điện tử đang "khát" electron kia. Khi một electrophile đủ mạnh tiến đến gần, nó sẽ bị hút vào đám mây electron này và bắt đầu quá trình thay thế.
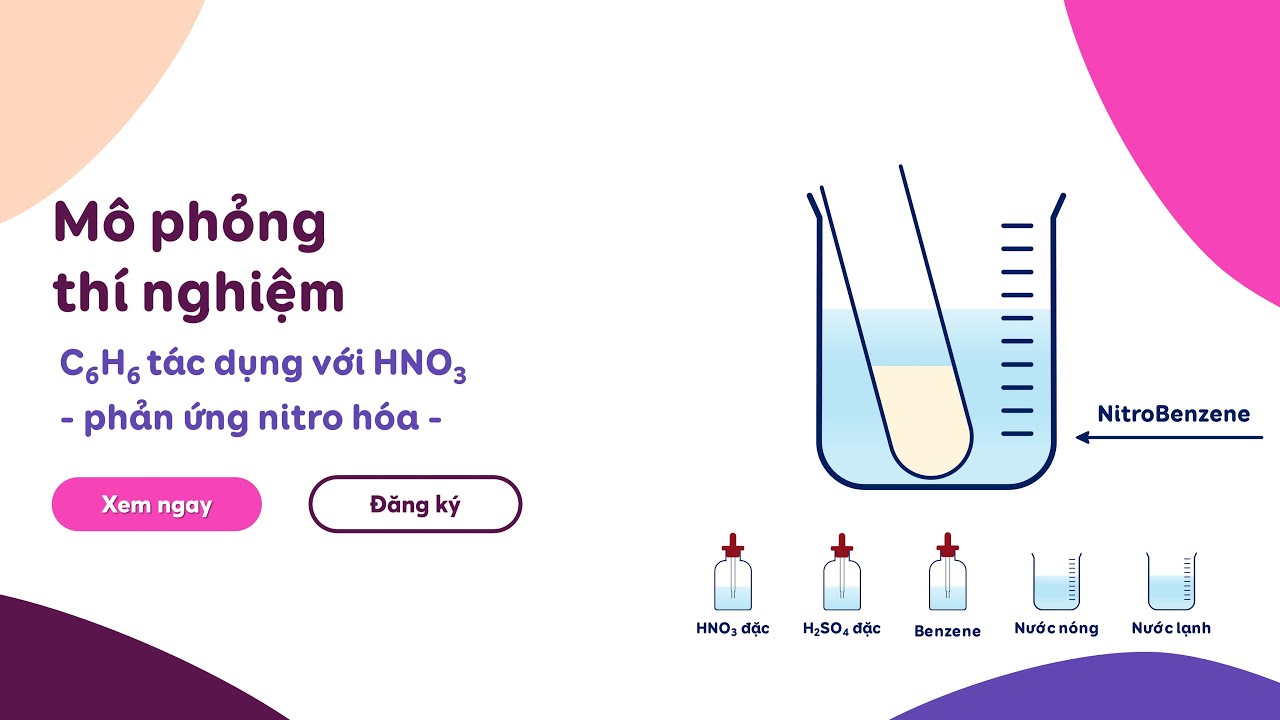
Hãy xem vài ví dụ kinh điển nhé.
-
Nitro hóa benzen: Đây là phản ứng dùng để gắn nhóm nitro (-NO2) vào vòng benzen. Người ta thường cho benzen tác dụng với hỗn hợp axit nitric đặc và axit sulfuric đặc (đóng vai trò xúc tác và tạo ra tác nhân thân điện tử mạnh là ion nitroni NO2+). Kết quả là chúng ta thu được nitrobenzen, một chất rất quan trọng trong công nghiệp hóa chất.
-
Halogen hóa benzen: Muốn gắn nguyên tử halogen như brom (Br) hay clo (Cl) vào vòng benzen? Phản ứng SE là câu trả lời. Ví dụ, cho benzen tác dụng với brom lỏng khi có mặt xúc tác là sắt(III) bromua (FeBr3), bạn sẽ thu được brombenzen. Tương tự với clo và xúc tác FeC l3. Xúc tác này giúp tạo ra tác nhân thân điện tử là Br+ hoặc Cl+.
Phản ứng thế ái lực điện tử không chỉ giới hạn ở benzen mà còn xảy ra trên nhiều hợp chất vòng thơm khác, và là chìa khóa để tổng hợp vô số hóa chất hữu cơ quan trọng, từ thuốc nhuộm, dược phẩm đến vật liệu polymer. Hiểu rõ cơ chế này giúp chúng ta dự đoán sản phẩm, kiểm soát phản ứng và tạo ra những hợp chất mong muốn một cách hiệu quả.
Thế Gốc SR Cuộc Chơi Của Các Gốc Tự Do
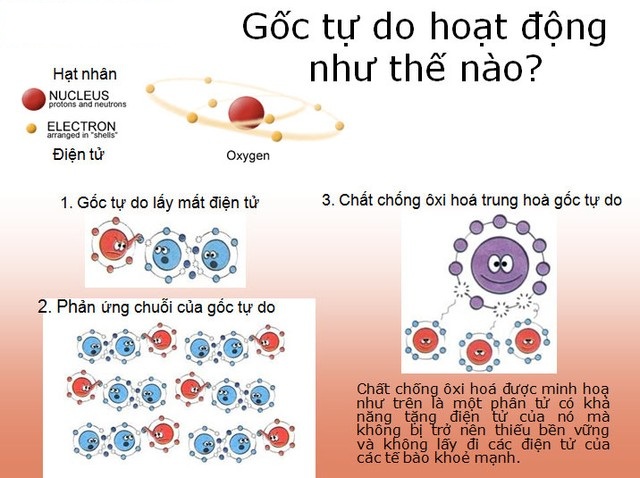
Ankan, mấy anh chàng hydrocarbon "no đủ" chỉ toàn liên kết đơn, tưởng chừng như hiền lành chẳng tham gia phản ứng gì ghê gớm. Thế nhưng, dưới điều kiện đặc biệt, họ lại có thể tham gia vào một kiểu phản ứng thế cực kỳ thú vị: phản ứng thế gốc SR. Đây là cuộc chơi của những "kẻ nổi loạn" trong hóa học – các gốc tự do.
Khác với phản ứng thế ion cần tác nhân mang điện tích rõ ràng, phản ứng thế gốc diễn ra thông qua sự tham gia của gốc tự do. Gốc tự do là những nguyên tử hay nhóm nguyên tử có electron độc thân, cực kỳ kém bền và hoạt động mạnh mẽ. Vì ankan không có liên kết pi hay các nhóm chức dễ bị tấn công bởi ion, nên để phản ứng, cần phải "kích hoạt" chúng hoặc tạo ra những tác nhân đủ mạnh để phá vỡ liên kết C-H bền vững.
Phản ứng thế gốc SR thường diễn ra theo một cơ chế "dây chuyền" gồm ba giai đoạn nối tiếp nhau, cần có năng lượng từ ánh sáng (ký hiệu hν) hoặc nhiệt độ cao để khởi động:
-
Giai đoạn Khơi mào: Giống như châm ngòi cho một chuỗi domino vậy đó. Năng lượng (ánh sáng hoặc nhiệt) làm đứt gãy liên kết cộng hóa trị trong phân tử tác nhân (thường là halogen X₂), tạo ra các gốc tự do ban đầu. Ví dụ, Cl₂ dưới tác dụng của ánh sáng sẽ tách thành hai gốc clo tự do (Cl•).
X-X --(hν hoặc nhiệt)--> X• + X• -
Giai đoạn Phát triển mạch: Đây là lúc "cuộc đua" thực sự diễn ra. Các gốc tự do vừa sinh ra sẽ tấn công vào phân tử ankan, "giật" lấy một nguyên tử hydro, tạo thành gốc alkyl tự do (R•) và một phân tử mới (HX). Gốc alkyl tự do này lại không yên, nó tiếp tục tấn công vào một phân tử halogen khác (X₂), "giật" lấy nguyên tử halogen, tạo ra sản phẩm thế (R-X) và tái tạo gốc halogen tự do (X•). Cứ thế, gốc tự do được sinh ra liên tục, làm phản ứng chạy ào ào theo một vòng lặp.
R-H + X• --> R• + H-X
R• + X-X --> R-X + X• -
Giai đoạn Tắt mạch: Cuộc chơi nào rồi cũng đến lúc tàn. Khi các gốc tự do va chạm vào nhau, chúng sẽ kết hợp lại, tạo thành các phân tử bền và không còn khả năng tiếp tục "dây chuyền" phản ứng nữa. Sự kết hợp này có thể là hai gốc halogen, hai gốc alkyl, hoặc một gốc halogen với một gốc alkyl. Khi nồng độ gốc tự do giảm xuống đủ thấp, phản ứng sẽ dừng lại.
X• + X• --> X-X
R• + R• --> R-R
R• + X• --> R-X
Phản ứng thế gốc SR là đặc trưng của ankan khi phản ứng với halogen dưới điều kiện ánh sáng hoặc nhiệt. Kết quả thường là hỗn hợp các sản phẩm thế ở nhiều vị trí khác nhau trên mạch carbon, đôi khi còn có sản phẩm tạo thành từ sự kết hợp của các gốc alkyl. Điều này làm cho phản ứng thế gốc ít được dùng để điều chế một sản phẩm duy nhất trong tổng hợp hữu cơ so với các phản ứng thế ion chọn lọc hơn.
Phản ứng thế: Những ứng dụng bất ngờ
Tưởng chừng chỉ là những phương trình hóa học khô khan trong sách giáo khoa, nhưng hóa ra phản ứng thế lại len lỏi vào rất nhiều khía cạnh của đời sống và công nghiệp. Từ việc tạo ra những chất quen thuộc cho đến xử lý ô nhiễm môi trường, vai trò của chúng thật đáng nể.
Điều chế khí Hydro và hơn thế nữa
Một trong những ví dụ kinh điển nhất về phản ứng thế được dùng để điều chế chất chính là cách chúng ta tạo ra khí Hydro (H₂) trong phòng thí nghiệm. Bạn còn nhớ thí nghiệm cho kim loại Kẽm (Zn) vào dung dịch axit clohidric (HCl) chứ? Đó chính là một phản ứng thế điển hình: nguyên tử Kẽm đã "thế chỗ" nguyên tử Hydro trong axit, giải phóng khí Hydro và tạo thành muối kẽm clorua. Phản ứng này đơn giản, dễ thực hiện, rất phù hợp cho việc thu một lượng nhỏ khí H₂ để làm thí nghiệm.
Trong công nghiệp, nhu cầu về Hydro là cực kỳ lớn, dùng trong nhiều quy trình sản xuất quan trọng như tổng hợp amoniac để sản xuất phân bón, hydro hóa dầu ăn lỏng thành bơ thực vật, hay làm nhiên liệu sạch trong tương lai. Tuy nhiên, để sản xuất Hydro trên quy mô công nghiệp khổng lồ, người ta thường dùng các phương pháp khác hiệu quả và kinh tế hơn, ví dụ như reforming khí thiên nhiên (chủ yếu là metan) bằng hơi nước ở nhiệt độ cao. Dù cơ chế có phức tạp hơn, nhưng phản ứng thế kim loại với axit vẫn là một minh chứng rõ ràng về cách phản ứng thế có thể được dùng để "điều chế" một chất cụ thể.

Phản ứng thế trong đời sống và sản xuất
Không chỉ dừng lại ở việc điều chế Hydro, phản ứng thế còn góp mặt trong nhiều lĩnh vực khác.
Trong ngành luyện kim, phản ứng thế đóng vai trò quan trọng. Chẳng hạn, để thu được kim loại đồng (Cu) từ dung dịch muối đồng sunfat (CuSO₄), người ta có thể dùng một kim loại hoạt động mạnh hơn đồng, ví dụ như sắt (Fe) hoặc kẽm (Zn), cho tác dụng với dung dịch này. Kim loại mạnh hơn sẽ "thế chỗ" đồng trong muối, đẩy đồng ra ở dạng kim loại nguyên chất. Phản ứng như Fe + CuSO₄ → FeSO₄ + Cu là một ví dụ điển hình. Đây là cách đơn giản để thu hồi kim loại hoặc tinh chế chúng.
Một ứng dụng thiết thực khác là trong xử lý nước thải. Nước thải công nghiệp thường chứa các ion kim loại nặng độc hại như đồng (Cu²⁺), chì (Pb²⁺), kẽm (Zn²⁺). Bằng cách cho nước thải đi qua các vật liệu chứa kim loại hoạt động mạnh hơn (như sắt vụn), các ion kim loại nặng sẽ bị thế chỗ bởi ion sắt, kết tủa xuống và dễ dàng loại bỏ khỏi nước. Phản ứng thế giúp "dọn dẹp" bớt những chất ô nhiễm nguy hiểm này, góp phần bảo vệ môi trường nước.
Như vậy, phản ứng thế không chỉ là một khái niệm lý thuyết mà còn là công cụ hữu ích, được ứng dụng khéo léo để điều chế chất, thu hồi kim loại và xử lý ô nhiễm, mang lại nhiều lợi ích thiết thực cho cuộc sống.
Thực hành ngay với bài tập phản ứng thế
Nắm vững lý thuyết phản ứng thế là bước đầu tiên, nhưng để thực sự "chinh phục" loại phản ứng này, bạn cần phải cọ xát với các dạng bài tập đa dạng. Hóa học không chỉ nằm trên trang sách, mà còn ẩn mình trong những bài toán cần bạn "giải mã".
Hãy thử tưởng tượng bạn đang cần xác định sản phẩm chính khi cho một hydrocarbon phức tạp phản ứng với halogen dưới ánh sáng, hoặc tính toán lượng chất cần dùng để điều chế một hợp chất cụ thể qua phản ứng thế. Những tình huống này đòi hỏi sự vận dụng linh hoạt kiến thức về cơ chế, điều kiện phản ứng và cả kỹ năng tính toán. Làm sao để phân loại các bài tập này và có phương pháp tiếp cận hiệu quả nhất cho từng dạng?
Luyện Kỹ Năng Giải Bài Tập Thế Halogen Ankan
Sau khi nắm vững khái niệm và cơ chế phản ứng thế halogen vào ankan, việc áp dụng vào bài tập thực tế là bước không thể thiếu để củng cố kiến thức. Các dạng bài thường xoay quanh việc xác định sản phẩm, tính toán hiệu suất, hoặc ngược lại, tìm ra chất ban đầu khi biết sản phẩm.
Dạng bài phổ biến nhất là dự đoán sản phẩm thu được khi cho ankan phản ứng với halogen dưới điều kiện thích hợp (ánh sáng, nhiệt độ). Chìa khóa ở đây là ‘quy tắc’ về độ linh động của nguyên tử hydro: hydro gắn với carbon bậc ba dễ bị thế nhất, sau đó đến bậc hai, và cuối cùng là bậc một. Chính vì thế, sản phẩm chính của phản ứng thường là nơi halogen ‘nhảy’ vào vị trí hydro ở carbon bậc cao nhất. Tất nhiên, phản ứng không phải lúc nào cũng ‘nghe lời’ tuyệt đối, vẫn có sản phẩm phụ tạo thành từ việc thế vào các hydro bậc thấp hơn, tạo nên hỗn hợp đồng phân. Nhiệm vụ của bạn là xác định được tất cả các sản phẩm có thể có và chỉ ra sản phẩm chính.
Đừng quên các bài toán tính toán nha! Thường gặp nhất là tính hiệu suất phản ứng. Tưởng tượng bạn ‘nấu’ một món hóa học, hiệu suất chính là xem bạn ‘nấu’ ra được bao nhiêu ‘món’ so với lượng nguyên liệu bạn có thể tạo ra tối đa theo công thức. Công thức tính hiệu suất thì ‘kinh điển’ rồi: Hiệu suất (%) = (Khối lượng hoặc số mol sản phẩm thực tế / Khối lượng hoặc số mol sản phẩm lý thuyết) * 100%. Dạng này đòi hỏi bạn phải nắm chắc tỉ lệ mol theo phương trình và các bước tính toán cơ bản.
Cuối cùng, có những bài ‘hóc búa’ hơn một tẹo, bắt bạn ‘đi ngược’ lại quá trình. Tức là, đề bài cho bạn biết sản phẩm thế halogen rồi, và bạn phải tìm ra ‘nguyên liệu’ ankan ban đầu là gì. Bí quyết là hãy nhìn thật kỹ vị trí mà nguyên tử halogen đang ‘ngự trị’ trong sản phẩm. Hãy thử ‘tháo’ halogen đó ra và ‘đặt’ lại một nguyên tử hydro vào đúng vị trí đó. Cấu trúc ankan bạn vừa ‘ghép’ lại chính là chất ban đầu. Nếu có nhiều sản phẩm thế đồng phân, bạn cần xem xét tất cả các vị trí có thể thế để xác định ankan ban đầu có thể tạo ra chúng.
Tóm lại, ‘chinh phục’ được ba dạng bài tập này là bạn đã nắm trong tay ‘chìa khóa’ để xử lý hầu hết các câu hỏi về phản ứng thế halogen của ankan rồi đấy. Cứ luyện tập thật nhiều nhé!
Bài tập thế trên xicloankan và vòng thơm
Phản ứng thế không chỉ là "sân chơi" của mỗi ankan mạch hở đâu nhé. Khi gặp các hidrocacbon "có vòng" như xicloankan hay vòng thơm, phản ứng thế cũng diễn ra đấy, nhưng lại có những điểm đặc biệt cần lưu ý khi làm bài tập.
Với xicloankan, nếu vòng nhỏ (như xiclopropan, xiclobutan) thì phản ứng thế halogen cần điều kiện ánh sáng, tương tự ankan. Tuy nhiên, điểm khác biệt nằm ở cấu trúc vòng. Ví dụ, trong xiclopropan, tất cả các nguyên tử H đều tương đương nhau, nên khi thế chỉ cho 1 sản phẩm thế monoclo duy nhất. Nhưng với xicloankan lớn hơn hoặc có nhánh, vị trí thế sẽ khác nhau, dẫn đến nhiều đồng phân sản phẩm. Bài tập thường yêu cầu xác định sản phẩm chính (nếu có quy tắc thế tương tự ankan) hoặc đếm số đồng phân thế monoclo, điclo có thể tạo thành.
Chuyển sang vòng thơm, điển hình là benzen và các đồng đẳng. Phản ứng thế trên vòng thơm thường là thế ái lực điện tử, cần xúc tác (như Fe, AlCl3 cho halogen hóa; H2SO4 đặc cho nitro hóa). Vấn đề thú vị ở đây là khi trên vòng benzen đã có sẵn một nhóm thế, nhóm thế đó sẽ "chỉ đạo" vị trí mà nhóm thế mới sẽ đi vào. Có nhóm thế định hướng ortho, para (như -CH3, -OH, -NH2, halogen) và nhóm thế định hướng meta (như -NO2, -COOH, -CHO).
Bài tập về thế trên vòng thơm rất đa dạng:
- Xác định sản phẩm: Dựa vào nhóm thế có sẵn để dự đoán sản phẩm chính (thế vào vị trí ortho, meta hay para). Ví dụ, nitro hóa toluen (có nhóm -CH3 định hướng o, p) sẽ ưu tiên tạo ra o-nitrotoluen và p-nitrotoluen.
- Đếm đồng phân: Tính số lượng đồng phân thế điclo, triclo… của benzen hoặc các đồng đẳng. Cần cẩn thận xem xét tính đối xứng của phân tử. Ví dụ, thế điclo benzen có 3 đồng phân (o, m, p), nhưng thế điclo toluen thì phức tạp hơn vì vị trí thế ban đầu (-CH3) đã phá vỡ tính đối xứng hoàn toàn.
- Tính toán liên quan: Các bài tập tính hiệu suất phản ứng, lượng chất tham gia hoặc sản phẩm tạo thành dựa trên phương trình hóa học và dữ kiện đề bài. Đôi khi cần kết hợp với các phản ứng khác của sản phẩm.
Để làm tốt các dạng bài này, bạn cần nắm vững cấu trúc của xicloankan và vòng thơm, đặc biệt là ảnh hưởng của các nhóm thế lên khả năng phản ứng và vị trí thế trên vòng thơm. Luyện tập đếm đồng phân một cách hệ thống sẽ giúp bạn không bỏ sót trường hợp nào.
