Từng hạt cát, từng giọt nước, từng tế bào trong cơ thể bạn – tất cả đều được dệt nên từ những thành phần cơ bản nhất mà chúng ta gọi là nguyên tố hóa học. Hãy nghĩ xem, chỉ với khoảng hơn trăm loại "viên gạch" này, vũ trụ đã tạo ra vô vàn vật chất khác nhau, từ những đám mây khí khổng lồ đến những kim loại quý hiếm. Điều gì khiến mỗi nguyên tố trở nên độc nhất, và làm thế nào mà chúng lại xuất hiện trên Trái Đất này? Liệu có phải tất cả đều được "nấu chảy" từ một nơi nào đó rất xa xôi trong không gian?
Viên gạch đầu tiên của vũ trụ là gì
Bạn đã bao giờ tự hỏi, mọi thứ xung quanh chúng ta, từ không khí ta hít thở, nước ta uống, đến chính cơ thể chúng ta, được tạo nên từ cái gì chưa? Tưởng tượng xem, vũ trụ rộng lớn này giống như một ngôi nhà khổng lồ, còn những "viên gạch" cơ bản nhất để xây nên ngôi nhà ấy chính là nguyên tố hóa học.
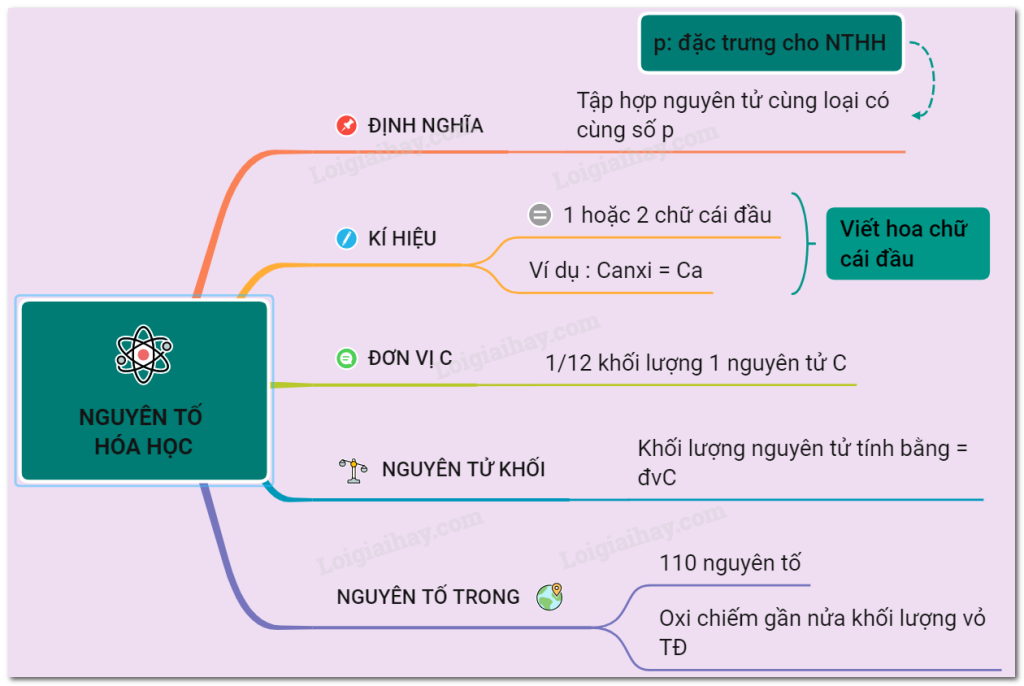
Vậy, nói một cách đơn giản nhất, nguyên tố hóa học là một loại vật chất tinh khiết mà chúng ta không thể phân tách nó thành những chất đơn giản hơn bằng các phản ứng hóa học thông thường. Giống như bạn không thể dùng búa đập một viên gạch thành nửa viên gạch mà nó vẫn là viên gạch vậy. Mỗi nguyên tố là độc nhất vô nhị, mang bản sắc riêng không lẫn vào đâu được.

Điều gì tạo nên sự độc nhất ấy? Câu trả lời nằm sâu bên trong hạt nhân nguyên tử của nó. Mỗi nguyên tố được định danh chỉ bằng một thứ duy nhất: số lượng hạt proton có trong hạt nhân của nguyên tử đó. Con số này được gọi là số hiệu nguyên tử (ký hiệu là Z).
Hãy nghĩ về số proton như là "chứng minh nhân dân" của nguyên tố vậy. Nguyên tử nào có 1 proton trong hạt nhân? Chắc chắn đó là Hydrogen (Hydro). Nguyên tử nào có 2 proton? Đó chỉ có thể là Helium (Heli). Cứ thế, nguyên tử có 6 proton là Carbon (Cacbon), 8 proton là Oxygen (Oxy), 26 proton là Iron (Sắt)… Chỉ cần thay đổi số lượng proton, bạn sẽ có ngay một nguyên tố hoàn toàn khác, với tính chất hoàn toàn khác.
Chính số lượng proton này quyết định cách các electron (những hạt mang điện tích âm bay xung quanh hạt nhân) được sắp xếp. Và cách electron "ở" như thế nào lại là yếu tố then chốt quyết định tính chất hóa học của nguyên tố đó – tức là nó sẽ phản ứng, kết hợp với các nguyên tố khác ra sao.
Nói tóm lại, nguyên tố hóa học là khái niệm nền tảng nhất khi nói về vật chất. Nó là chất tinh khiết không thể phân hủy hóa học, được cấu tạo từ một loại nguyên tử duy nhất, và điều quan trọng nhất để nhận diện nó chính là số lượng proton trong hạt nhân nguyên tử của nó.
Dấu hiệu và Cân nặng của Nguyên tố
Tưởng tượng thế giới hóa học như một vũ trụ thu nhỏ, nơi mỗi nguyên tố là một cư dân đặc biệt. Để gọi tên, nhận diện và thậm chí là "cân" chúng, các nhà khoa học đã tạo ra một hệ thống riêng cực kỳ hiệu quả. Đó chính là ký hiệu hóa học và khái niệm nguyên tử khối.
Mỗi nguyên tố đều có một "dấu hiệu" riêng, một ký hiệu hóa học độc nhất vô nhị. Đây là một quy ước quốc tế, giống như một ngôn ngữ chung mà mọi nhà hóa học trên thế giới đều hiểu. Ký hiệu này thường được lấy từ một hoặc hai chữ cái đầu tiên trong tên tiếng Latinh, Hy Lạp hoặc đôi khi là tiếng Anh của nguyên tố đó. Chữ cái đầu tiên luôn viết hoa, còn chữ thứ hai (nếu có) thì viết thường. Ví dụ, Hydro là H, Oxy là O, nhưng Sắt lại là Fe (từ "Ferrum" trong tiếng Latinh), còn Vàng là Au (từ "Aurum"). Nhờ có những ký hiệu này, chúng ta có thể viết các công thức hóa học phức tạp một cách gọn gàng và dễ hiểu.
Bên cạnh dấu hiệu nhận biết, mỗi nguyên tử của một nguyên tố còn có "cân nặng" riêng, gọi là nguyên tử khối. Vì nguyên tử quá bé nhỏ, không thể đặt lên cân thông thường để đo, người ta dùng một đơn vị đo lường đặc biệt gọi là đơn vị khối lượng nguyên tử, viết tắt là đvC (hoặc amu, u). Đơn vị này được định nghĩa dựa trên khối lượng của nguyên tử Carbon-12. Nguyên tử khối của một nguyên tố cho biết khối lượng trung bình của một nguyên tử nguyên tố đó, tính bằng đvC. Con số này thường được ghi cùng với ký hiệu của nguyên tố trong Bảng tuần hoàn. Ví dụ, nguyên tử khối của Hydro xấp xỉ 1 đvC, của Oxy xấp xỉ 16 đvC. Điều này cho chúng ta biết một nguyên tử Oxy nặng gấp khoảng 16 lần một nguyên tử Hydro. Hiểu được ký hiệu và nguyên tử khối chính là bước đầu tiên để "giải mã" thế giới vi mô đầy kỳ thú của các nguyên tố.
Chuyến Phiêu Lưu Của Các Nguyên Tố
Sau khi đã biết nguyên tố là gì và được biểu diễn ra sao, giờ là lúc chúng ta cùng nhau quay ngược dòng thời gian, khám phá xem những "viên gạch" vũ trụ này đến từ đâu. Liệu bạn có bao giờ tự hỏi, nguyên tử sắt trong máu bạn, hay nguyên tử vàng lấp lánh trên trang sức, chúng được tạo ra từ khi nào và ở đâu trong vũ trụ rộng lớn này không? Như nhà thiên văn học nổi tiếng Carl Sagan từng nói, "Chúng ta được tạo nên từ vật chất của các vì sao" – một câu nói chứa đựng sự thật khoa học sâu sắc về nguồn gốc của chính chúng ta và mọi thứ xung quanh. Hành trình của một nguyên tố không hề đơn giản, nó bắt đầu từ những khoảnh khắc đầu tiên của vũ trụ, qua hàng tỷ năm tiến hóa của các ngôi sao, và cuối cùng là những nỗ lực không ngừng nghỉ của con người để hiểu, phân loại và sắp xếp chúng một cách khoa học.
Bếp lò vũ trụ tạo ra nguyên tố
Hãy tưởng tượng vũ trụ thuở sơ khai, chỉ vài khoảnh khắc sau Vụ Nổ Lớn. Mọi thứ nóng bỏng và đặc quánh đến không thể tin nổi. Trong cái "nồi áp suất" khổng lồ đó, các hạt hạ nguyên tử như proton và neutron liên tục va chạm. Khi vũ trụ giãn nở và nguội đi một chút, đủ để các hạt này kết hợp lại, nhưng chỉ trong một thời gian rất ngắn ngủi. Kết quả của màn "phối hợp" tốc độ cao này là sự ra đời của những nguyên tố đầu tiên và nhẹ nhất: chủ yếu là Hydro và Heli, cùng một lượng rất nhỏ Lithium. Đây chính là nền tảng vật chất cho mọi thứ sau này.
Nhưng vũ trụ đâu chỉ có Hydro và Heli? Làm sao có Sắt trong máu chúng ta, Canxi trong xương hay Vàng lấp lánh? Bí mật nằm ở những "nhà máy" khổng lồ rải rác khắp không gian: các ngôi sao. Sau khi Vụ Nổ Lớn kết thúc, Hydro và Heli lang thang trong không gian dưới tác dụng của lực hấp dẫn bắt đầu tụ lại, nén chặt đến mức đủ để khởi động phản ứng nhiệt hạch ở lõi. Ngôi sao ra đời, và bên trong nó là một lò luyện kim vũ trụ.
Trong lòng các ngôi sao, phản ứng tổng hợp hạt nhân diễn ra liên tục. Những nguyên tố nhẹ hơn bị "nấu" lại thành nguyên tố nặng hơn. Ban đầu là Hydro thành Heli. Khi Hydro cạn dần, ngôi sao lớn hơn sẽ bắt đầu tổng hợp Heli thành Carbon, Oxy. Những ngôi sao cực lớn còn có thể tiếp tục quá trình này, tạo ra các nguyên tố nặng hơn nữa như Neon, Magie, Silic, Lưu huỳnh, cho đến Sắt. Sắt là điểm dừng của quá trình tổng hợp năng lượng trong sao, vì tổng hợp hạt nhân tạo ra Sắt không giải phóng năng lượng nữa.
Vậy còn những nguyên tố nặng hơn Sắt thì sao? Đồng, Chì, Vàng, Uranium… chúng đến từ đâu? Câu trả lời nằm ở những khoảnh khắc cuối đời đầy kịch tính của các ngôi sao khổng lồ: những vụ nổ siêu tân tinh. Khi một ngôi sao lớn cạn kiệt nhiên liệu và sụp đổ dưới trọng lực của chính nó, một vụ nổ kinh hoàng xảy ra. Năng lượng khổng lồ từ vụ nổ này cung cấp điều kiện cần thiết để các hạt nhân nguyên tử "bắt" thêm neutron và trải qua các phản ứng hạt nhân phức tạp khác. Chính trong cơn "hấp hối" dữ dội của siêu tân tinh mà các nguyên tố siêu nặng được tạo ra. Sau đó, vụ nổ này thổi tung vật chất của ngôi sao – bao gồm tất cả các nguyên tố vừa được tạo ra và tổng hợp trước đó – vào không gian liên sao.
Vật chất từ các vụ nổ siêu tân tinh và gió sao (vật chất thoát ra từ sao trong suốt quá trình sống) trộn lẫn vào các đám mây khí và bụi trong vũ trụ. Những đám mây này sau đó lại co sụp dưới trọng lực để hình thành các thế hệ sao và hành tinh mới. Hệ Mặt Trời của chúng ta, Trái Đất và cả cơ thể bạn – tất cả đều được tạo nên từ "tro bụi" của những ngôi sao đã chết từ rất lâu trước đây. Thật kỳ diệu khi nghĩ rằng chúng ta được cấu thành từ những nguyên tố đã có một hành trình dài từ Vụ Nổ Lớn, qua lòng sao nóng bỏng và những vụ nổ siêu tân tinh dữ dội, trước khi tụ họp lại ở đây.
Từ Giả Kim Đến Bảng Tuần Hoàn Vĩ Đại
Câu chuyện về việc con người đi tìm hiểu "viên gạch" cơ bản xây dựng nên mọi thứ thật dài và đầy bất ngờ, bắt đầu từ những thời xa xưa lắm. Hồi đó, người ta tin vào những thứ gọi là giả kim thuật. Họ nghĩ rằng mọi vật chất được tạo nên từ chỉ vài nguyên tố cơ bản thôi, như đất, nước, lửa, và không khí chẳng hạn. Ước mơ lớn nhất của các nhà giả kim là biến kim loại bình thường như chì thành vàng ròng. Dù không thành công trong việc luyện vàng, nhưng chính những thí nghiệm miệt mài, đôi khi hơi bí ẩn ấy lại giúp họ khám phá ra nhiều chất mới, đặt nền móng cho hóa học sau này.
Mãi đến thế kỷ 17, một nhà khoa học người Ireland tên là Robert Boyle mới đưa ra một định nghĩa rõ ràng hơn về nguyên tố. Ông nói rằng, nguyên tố là những chất không thể phân chia nhỏ hơn nữa bằng các phương pháp hóa học thông thường. Đây là một bước ngoặt lớn, đánh dấu sự chuyển mình từ giả kim thuật sang hóa học thực sự.
Sau đó, hàng loạt nhà khoa học khác nối tiếp cuộc hành trình. Antoine Lavoisier, người được coi là cha đẻ của hóa học hiện đại, đã lập ra danh sách các chất mà ông tin là nguyên tố và nhấn mạnh tầm quan trọng của việc đo lường chính xác trong hóa học. Rồi đến John Dalton với thuyết nguyên tử, cho rằng mỗi nguyên tố có những nguyên tử riêng biệt với khối lượng đặc trưng.

Khi số lượng nguyên tố được phát hiện ngày càng nhiều, một vấn đề nảy sinh: làm sao để sắp xếp chúng một cách có hệ thống? Nhiều người đã thử sức. Johann Wolfgang Döbereiner nhận thấy một số nhóm ba nguyên tố có tính chất tương tự nhau (ông gọi là bộ ba). John Newlands thì sắp xếp các nguyên tố theo khối lượng nguyên tử và nhận thấy tính chất lặp lại sau mỗi tám nguyên tố, giống như các nốt nhạc (ông gọi là định luật quãng tám). Tuy nhiên, những cách sắp xếp này vẫn còn nhiều hạn chế và chưa bao quát hết các nguyên tố đã biết.
Và rồi, vào năm 1869, một thiên tài người Nga tên là Dmitri Mendeleev đã tạo nên một bước đột phá vĩ đại. Ông cũng sắp xếp các nguyên tố theo khối lượng nguyên tử tăng dần, nhưng điều đặc biệt là ông nhận ra rằng cần phải để lại những chỗ trống trong bảng của mình. Mendeleev tin rằng những chỗ trống đó dành cho các nguyên tố chưa được phát hiện, và ông thậm chí còn dự đoán được tính chất của chúng dựa vào vị trí trong bảng. Sự táo bạo và chính xác trong những dự đoán này đã chứng minh sức mạnh và tính đúng đắn của Bảng tuần hoàn mà ông xây dựng, mở ra một kỷ nguyên mới trong việc nghiên cứu và hiểu biết về thế giới vật chất.
Vũ trụ này là một bức tranh khổng lồ được vẽ nên từ vô vàn các nguyên tố, mỗi loại lại mang một "tính cách" riêng biệt. Bạn có bao giờ tự hỏi tại sao vàng thì lấp lánh và dẫn điện tốt, trong khi khí oxy lại vô hình và giúp duy trì sự sống? Sự khác biệt đáng kinh ngạc này không phải ngẫu nhiên. Các nhà khoa học đã dày công nghiên cứu và nhận ra rằng, dù số lượng nguyên tố rất nhiều, chúng ta hoàn toàn có thể gom chúng lại thành các nhóm dựa trên những đặc điểm chung về vật lý và hóa học. Vậy, đâu là ranh giới phân chia thế giới nguyên tố thành kim loại, phi kim và á kim đầy màu sắc này?
Kim loại: Ánh Kim và Sức Mạnh Tiềm Ẩn
Bước vào thế giới hóa học, chúng ta không thể không nhắc đến nhóm nguyên tố kim loại, những "ngôi sao" sáng giá và quen thuộc trong cuộc sống hàng ngày. Từ chiếc thìa bạn dùng ăn cơm, sợi dây điện trong nhà, cho đến khung xe đạp hay viên pin nhỏ xíu, đâu đâu cũng thấy bóng dáng của kim loại. Vậy điều gì làm nên sự đặc biệt của chúng?
Nhìn chung, các nguyên tố kim loại thường xuất hiện dưới dạng chất rắn ở nhiệt độ phòng, trừ anh chàng Thủy ngân hơi "lạc loài" là chất lỏng. Chúng có vẻ ngoài lấp lánh đặc trưng, hay còn gọi là ánh kim, dễ dàng dẫn điện và dẫn nhiệt cực tốt. Bạn có để ý không, nồi niêu xoong chảo thường làm bằng kim loại để nấu ăn nhanh chín, hay dây điện luôn làm từ đồng hoặc nhôm để dòng điện chạy vèo vèo? Chưa hết, kim loại còn có khả năng biến hình tài tình: có thể dát mỏng như vàng lá hay kéo dài thành sợi mảnh như dây thép, nhờ tính dẻo và tính dai đặc trưng.
Bí mật đằng sau những tính chất vật lý ấy nằm ở cấu trúc vi mô, cụ thể là số electron ở lớp ngoài cùng của nguyên tử. Hầu hết các nguyên tố kim loại chỉ có 1, 2 hoặc 3 electron ở lớp vỏ ngoài cùng này. Chúng có xu hướng "hào phóng", sẵn sàng nhường đi những electron "lẻ loi" đó để đạt được cấu hình electron bền vững hơn. Chính sự dễ dàng cho đi electron này là chìa khóa giải thích nhiều tính chất hóa học của kim loại.
Khi gặp gỡ oxy, các nguyên tố kim loại thường phản ứng để tạo thành các oxit. Điều thú vị là, những oxit kim loại này đa phần có tính bazơ. Nghĩa là, khi tan trong nước (nếu có thể), chúng sẽ tạo ra dung dịch bazơ, hoặc chúng có khả năng phản ứng trực tiếp với axit. Ví dụ điển hình là natri oxit (Na₂O) hay canxi oxit (CaO) – vôi sống quen thuộc. Tuy nhiên, cũng có một số kim loại đặc biệt như nhôm (Al) hay kẽm (Zn), oxit của chúng lại có tính lưỡng tính, vừa có thể phản ứng với axit như một bazơ, vừa có thể phản ứng với bazơ như một axit. Sự đa dạng này làm cho thế giới kim loại càng thêm phong phú và hấp dẫn.
Phi kim Những Đặc Điểm Riêng Biệt
Sau khi lượn qua thế giới kim loại lấp lánh, giờ mình cùng ngó sang "phe đối lập" một chút nhé: nhóm phi kim. Đây là những anh chàng, cô nàng có tính cách khá khác biệt so với kim loại đấy.
Nói về trạng thái vật lý, phi kim đa dạng hơn nhiều. Nếu kim loại hầu hết là chất rắn ở nhiệt độ phòng (trừ thủy ngân), thì phi kim lại có đủ cả. Nhiều phi kim quen thuộc là chất khí như Oxy, Nitơ, Hydro, Clo. Có một anh chàng là chất lỏng duy nhất: Brom. Còn lại thì cũng có những phi kim là chất rắn như Carbon (kim cương, than chì), Lưu huỳnh, Phốt pho. Nhìn chung, chúng không có vẻ ngoài bóng bẩy như kim loại đâu, thường thì xỉn màu hoặc có màu sắc đặc trưng.
Về cấu tạo nguyên tử, điểm chung của phi kim là lớp electron ngoài cùng thường có khá nhiều "hạt" (electron). Vì thế, xu hướng của chúng là tìm cách "gom" thêm electron từ nguyên tử khác để lớp ngoài cùng được đầy đủ, ổn định hơn. Chính cái "tính tham electron" này quyết định nhiều đến tính chất hóa học của chúng.
Khi phi kim kết hợp với oxy, chúng tạo ra các oxit. Điều đặc biệt là, khi hòa tan trong nước, các oxit của phi kim thường tạo thành axit. Ví dụ như khí CO2 (oxit của Carbon) tan trong nước tạo ra axit carbonic yếu trong nước ngọt có gas, hay SO2 (oxit của Lưu huỳnh) gây mưa axit khi gặp hơi nước trong không khí. Tuy nhiên, cũng có vài trường hợp ngoại lệ đáng yêu, tạo ra oxit trung tính, không có tính axit hay bazơ gì cả, như CO (Carbon monoxit) hay NO (Nitơ monoxit).
Tóm lại, phi kim mang những nét riêng không lẫn vào đâu được, từ trạng thái vật lý đa dạng đến cách chúng "chơi đùa" với electron và tạo ra các hợp chất có tính axit đặc trưng.
Á Kim Những Kẻ Trung Gian Đặc Biệt
Sau khi tìm hiểu về thế giới rộng lớn của kim loại và phi kim, chúng ta sẽ gặp một nhóm nguyên tố khá đặc biệt, họ không hẳn thuộc về phe nào cả mà nằm ở giữa, mang tính chất "lai" của cả hai. Đó chính là á kim. Cứ hình dung họ như những "cầu nối" thú vị trong Bảng tuần hoàn vậy.
Về mặt hình thức, á kim có thể trông giống kim loại, có vẻ ngoài sáng bóng đấy, nhưng đừng vội kết luận. Chúng lại giòn tan, dễ vỡ y như phi kim vậy. Cái tính chất "nửa vời" này thể hiện rõ nhất ở khả năng dẫn điện. Kim loại dẫn điện cực tốt, còn phi kim thì gần như là chất cách điện. Á kim thì sao? Họ dẫn điện, nhưng không giỏi bằng kim loại. Khả năng dẫn điện của chúng thay đổi rất nhạy bén theo nhiệt độ hoặc khi có pha tạp chất, và chính điều này đã mở ra một cánh cửa khổng lồ.
Cái tính chất dẫn điện "lưng chừng" ấy lại biến á kim thành những ngôi sao sáng trong ngành công nghệ hiện đại. Chất bán dẫn – nền tảng của mọi thiết bị điện tử từ chiếc điện thoại thông minh bạn đang cầm, máy tính, đến các tấm pin năng lượng mặt trời – chủ yếu được làm từ á kim, đặc biệt là Silicon và Germanium. Nhờ có á kim, chúng ta mới có được những mạch điện nhỏ gọn, phức tạp và hiệu quả đến vậy.

Không chỉ có vậy, oxit của á kim cũng thể hiện sự "lưỡng tính" đáng ngạc nhiên. Trong khi oxit kim loại thường có tính bazơ (phản ứng với axit), và oxit phi kim thường có tính axit (phản ứng với bazơ), thì oxit của á kim lại có thể "chơi" được với cả hai phe. Chúng phản ứng được cả với dung dịch axit mạnh lẫn dung dịch bazơ mạnh. Điều này cho thấy sự linh hoạt và vị trí độc đáo của á kim trong các phản ứng hóa học.
Tóm lại, dù số lượng không nhiều, nhóm á kim lại đóng vai trò cực kỳ quan trọng nhờ tính chất trung gian độc đáo của mình, đặc biệt là trong vai trò chất bán dẫn. Họ chính là những mảnh ghép không thể thiếu, nối liền hai thế giới kim loại và phi kim trong bức tranh hóa học rộng lớn.
Nguyên tố Hóa học: Xây dựng Thế giới Quanh Ta
Sau khi khám phá định nghĩa và nguồn gốc kỳ diệu của các nguyên tố, giờ là lúc nhìn xem những "viên gạch" vũ trụ này thực sự làm gì trong cuộc sống của chúng ta. Từ không khí ta hít thở, nước ta uống, đến cấu tạo phức tạp của cơ thể bạn hay chiếc điện thoại bạn đang cầm, tất cả đều được tạo nên từ các nguyên tố. Các nhà khoa học đã tìm ra cách "nói chuyện" về sự kết hợp của chúng thông qua những công thức hóa học tưởng chừng khô khan nhưng lại ẩn chứa bí mật về cách vạn vật tương tác. Bạn có bao giờ tự hỏi, làm thế nào mà chỉ vài chục loại "viên gạch" lại tạo nên một thế giới đa dạng đến vậy?
Nền móng của vạn vật
Thử nghĩ xem, mọi thứ xung quanh chúng ta, từ ngọn cỏ xanh mướt, đám mây bồng bềnh trên trời, chiếc điện thoại bạn đang cầm, cho đến chính cơ thể bạn, đều được tạo nên từ những gì? Không phải là phép màu hay vật liệu siêu nhiên nào cả, mà là từ những "viên gạch" cực kỳ cơ bản, không thể phân chia nhỏ hơn bằng phương pháp hóa học thông thường. Đó chính là các nguyên tố hóa học.
Tưởng tượng mà xem, vũ trụ rộng lớn này, với hàng tỷ thiên hà, sao chổi lướt đi trong không gian, hay những hành tinh xa xôi, tất cả đều được "lắp ráp" từ một bộ sưu tập tương đối nhỏ các nguyên tố. Từ vụ nổ Big Bang huyền thoại sinh ra Hydro và Heli, đến những lò phản ứng hạt nhân khổng lồ trong lòng các ngôi sao tạo ra các nguyên tố nặng hơn, chúng chính là nền tảng vật chất đầu tiên. Chúng bay lơ lửng trong không gian, tụ lại thành bụi vũ trụ, rồi kết dính với nhau để hình thành nên mọi thứ.
Trên Trái Đất này, vai trò của nguyên tố càng trở nên rõ ràng hơn bao giờ hết. Nước chúng ta uống là sự kết hợp của Hydro và Oxy. Muối ăn hàng ngày là Natri và Clo. Không khí chúng ta hít thở chủ yếu là Nitơ và Oxy. Vỏ Trái Đất rắn chắc là tập hợp của Silic, Oxy, Nhôm, Sắt và vô số nguyên tố khác. Mỗi vật liệu, dù là kim loại sáng bóng, nhựa dẻo dai hay gốm sứ cứng cáp, đều là sản phẩm của các nguyên tố kết hợp theo những cách đặc biệt.
Nhưng có lẽ vai trò kỳ diệu nhất của các nguyên tố nằm ở sự sống. Cơ thể chúng ta là một "nhà máy hóa học" phức tạp, nơi các nguyên tố đóng vai trò then chốt. Carbon là xương sống của mọi phân tử hữu cơ, từ đường, chất béo đến protein và DNA. Oxy giúp chúng ta hô hấp để tạo ra năng lượng. Sắt mang oxy đi khắp cơ thể trong máu. Canxi xây dựng nên xương và răng chắc khỏe. Kali và Natri duy trì hoạt động của thần kinh và cơ bắp. Ngay cả những nguyên tố vi lượng như Kẽm, Đồng, Selen, dù chỉ cần một lượng rất nhỏ, cũng cực kỳ quan trọng cho các chức năng sinh học.

Nói cách khác, nguyên tố hóa học không chỉ là khái niệm khô khan trong sách vở, mà chúng là nền móng thực sự của toàn bộ thế giới vật chất và sự sống. Hiểu về nguyên tố chính là mở cánh cửa để giải mã cách vũ trụ vận hành và cách cuộc sống tồn tại. Chúng là những khối xây dựng không thể thiếu, tạo nên sự đa dạng và phức tạp đến kinh ngạc mà chúng ta thấy mỗi ngày.
Đọc Hiểu Ký Hiệu Và Tính Khối Lượng
Khi nhìn vào thế giới hóa học, bạn sẽ thấy các nguyên tố được "viết" ra bằng những ký hiệu riêng biệt, giống như bảng chữ cái của vũ trụ vậy. Carbon là C, Oxygen là O, Calcium là Ca… Nhưng làm sao để biết chúng ta đang nói về bao nhiêu nguyên tử của một nguyên tố nào đó?
Đơn giản lắm! Đôi khi, bạn sẽ thấy một con số đứng ngay trước ký hiệu nguyên tố. Ví dụ như 2C, 5O, hay 3Ca. Con số này, gọi là hệ số, chỉ cho chúng ta biết có bao nhiêu "viên gạch" nguyên tử riêng lẻ của nguyên tố đó đang được nhắc đến.
- 2C nghĩa là chúng ta có hai nguyên tử Carbon.
- 5O nghĩa là chúng ta có năm nguyên tử Oxygen.
- 3Ca nghĩa là chúng ta có ba nguyên tử Calcium.
Nó giống như bạn nói "2 quả táo" hay "5 cái kẹo" vậy, chỉ số lượng thôi.
Vậy, nếu biết số lượng nguyên tử, làm sao để so sánh xem "đống" nguyên tố nào nặng hơn? Đây là lúc khái niệm nguyên tử khối phát huy tác dụng. Mỗi nguyên tố có một khối lượng riêng (tính theo đơn vị đvC mà chúng ta đã tìm hiểu). Để tính tổng khối lượng của một nhóm nguyên tử cùng loại, ta chỉ việc lấy số lượng nguyên tử nhân với nguyên tử khối của nguyên tố đó.
Hãy thử một bài toán nhỏ nhé!
Giả sử chúng ta biết nguyên tử khối xấp xỉ của Carbon là 12 đvC, Oxygen là 16 đvC, và Calcium là 40 đvC.
Bây giờ, hãy so sánh khối lượng của 2C và 5O.
- Khối lượng của 2C là: 2 (nguyên tử) * 12 (đvC/nguyên tử) = 24 đvC.
- Khối lượng của 5O là: 5 (nguyên tử) * 16 (đvC/nguyên tử) = 80 đvC.
So sánh 24 đvC và 80 đvC, rõ ràng 5O nặng hơn 2C rất nhiều!
Thử thêm một ví dụ khác: So sánh khối lượng của 3Ca và 5O.
- Khối lượng của 3Ca là: 3 (nguyên tử) * 40 (đvC/nguyên tử) = 120 đvC.
- Khối lượng của 5O là: 5 (nguyên tử) * 16 (đvC/nguyên tử) = 80 đvC.
Lần này, 3Ca lại nặng hơn 5O.
Hiểu cách đọc các ký hiệu có số đứng trước và biết cách áp dụng nguyên tử khối giúp chúng ta dễ dàng hình dung và tính toán những thứ cơ bản nhất trong thế giới hóa học, mở đường cho việc khám phá những công thức phức tạp hơn sau này.