Mọi thứ xung quanh ta, từ không khí ta hít thở, nước ta uống, đến viên đá ta nhặt, đều được tạo nên từ những thứ gọi là nguyên tố hóa học. Chúng là những viên gạch xây dựng cơ bản của vũ trụ, mỗi loại mang một "dấu vân tay" riêng biệt quyết định tính chất độc đáo của nó. Bạn có bao giờ tự hỏi, điều gì khiến vàng lấp lánh khác biệt với oxy vô hình, hay làm thế nào mà những vật chất nền tảng này lại xuất hiện trong vũ trụ rộng lớn và quan trọng đến vậy với cuộc sống của chúng ta?
Bản chất Nguyên tố: Từ Số Proton đến Khối lượng
Khi nhắc đến nguyên tố, bạn nghĩ ngay đến vàng, bạc, oxy hay hydro? Đúng vậy, chúng là những ví dụ điển hình. Nhưng điều gì thực sự làm nên "bản sắc" của một nguyên tố, phân biệt nó với hàng triệu hợp chất ngoài kia? Hóa ra, bí mật nằm sâu bên trong hạt nhân nguyên tử. Chỉ cần biết số lượng hạt proton tí hon ấy, chúng ta đã có thể gọi tên chính xác nguyên tố đó. Chẳng hạn, Carbon luôn có 6 proton, và chính con số 6 này định nghĩa nên Carbon, nền tảng của sự sống. Nhưng liệu mọi nguyên tử Carbon đều giống hệt nhau? Hay có những "biến thể" thú vị tồn tại, và làm thế nào chúng ta tính được khối lượng trung bình của chúng? Hãy cùng khám phá những khái niệm nền tảng này để hiểu rõ hơn về "chứng minh thư" của từng nguyên tố nhé.
Số proton Chìa khóa nhận biết Nguyên tố
Bạn có bao giờ thắc mắc, điều gì thực sự làm nên bản sắc của từng loại vật chất cơ bản trong vũ trụ này không? Giống như mỗi người có một dấu vân tay độc nhất, mỗi nguyên tố hóa học cũng sở hữu một đặc điểm riêng không thể trộn lẫn. Và bí mật đằng sau "dấu vân tay" ấy, theo định nghĩa hiện đại, chính là số lượng hạt proton nằm gọn trong hạt nhân nguyên tử của nó.
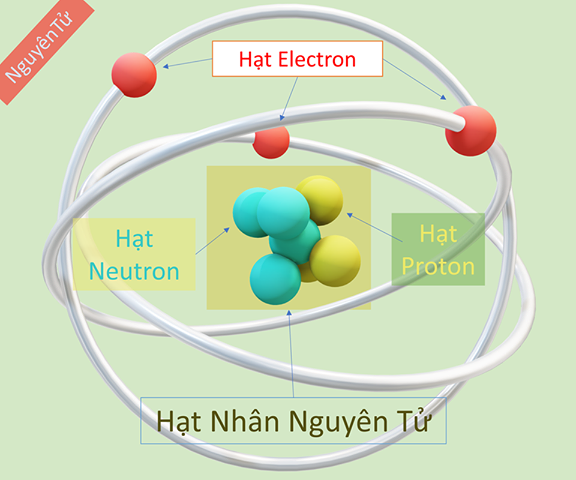
Hãy hình dung thế này: nguyên tử là những viên gạch siêu nhỏ xây nên mọi thứ. Mỗi viên gạch có một "lõi" ở giữa gọi là hạt nhân, chứa các hạt proton mang điện tích dương và neutron không mang điện. Xung quanh hạt nhân là các electron mang điện tích âm bay lượn. Trong tất cả những thành phần phức tạp ấy, chỉ duy nhất số lượng hạt proton quyết định nguyên tử đó thuộc về nguyên tố nào.
Chúng ta gọi số lượng proton này là số nguyên tử, ký hiệu là Z. Đây là con số "định danh" không thể thay đổi của một nguyên tố. Chỉ cần số proton thay đổi, ngay lập tức chúng ta có một nguyên tố hoàn toàn khác. Ví dụ, bất kỳ nguyên tử nào có đúng 6 proton trong hạt nhân thì chắc chắn đó là Carbon (C). Thêm một proton nữa, thành 7 proton, nó biến thành Nitrogen (N). Bớt đi một proton, còn 5 proton, nó lại là Boron (B). Đơn giản vậy đó!
Vậy thì, nguyên tố hóa học khác gì với hợp chất hóa học? Đây là điểm mấu chốt cần làm rõ. Nguyên tố là những dạng vật chất cơ bản nhất mà bạn không thể chia nhỏ hơn nữa thành các chất đơn giản hơn bằng các phản ứng hóa học thông thường. Chúng là những "viên gạch" nguyên bản.
Còn hợp chất? Chúng là sản phẩm của sự kết hợp hóa học giữa hai hay nhiều nguyên tố khác nhau theo một tỷ lệ xác định. Nước (H₂O) là một ví dụ kinh điển. Nó được tạo thành từ nguyên tố Hydro (H) và nguyên tố Oxi (O). Tính chất của nước hoàn toàn khác biệt với tính chất của Hydro (một khí rất dễ cháy) và Oxi (một khí duy trì sự cháy). Bạn có thể dùng phản ứng hóa học (như điện phân) để tách nước trở lại thành Hydro và Oxi, nhưng bạn không thể dùng phản ứng hóa học để biến Hydro thành thứ gì đó đơn giản hơn mà vẫn là Hydro.
Tóm lại, định nghĩa hiện đại về nguyên tố hóa học xoay quanh một con số duy nhất: số proton (số nguyên tử Z). Con số này là bản sắc cốt lõi, phân biệt nguyên tố này với nguyên tố khác và là nền tảng để chúng ta hiểu về thế giới vật chất quanh mình. Nguyên tố là những thành phần cơ bản, còn hợp chất là những "công trình" phức tạp hơn được xây dựng từ những thành phần cơ bản ấy.
Bên trong hạt nhân: Số nguyên tử, Đồng vị và Khối lượng
Tưởng tượng hạt nhân nguyên tử như một "trái tim" bé xíu, nằm sâu bên trong mỗi nguyên tử. Chính nơi đây chứa đựng những hạt hạ nguyên tử quan trọng bậc nhất, quyết định danh tính và nhiều đặc tính của nguyên tố. Hai cư dân chính trong trái tim này là proton và neutron.
Proton mang điện tích dương và có khối lượng đáng kể. Số lượng proton trong hạt nhân là điều duy nhất xác định đó là nguyên tố nào. Cứ có 6 proton thì chắc chắn đó là Carbon, có 8 proton thì là Oxygen, và cứ thế. Con số "ma thuật" này chính là số nguyên tử, thường được ký hiệu bằng chữ Z. Nó giống như số căn cước công dân của mỗi nguyên tố vậy, không bao giờ trùng lặp.
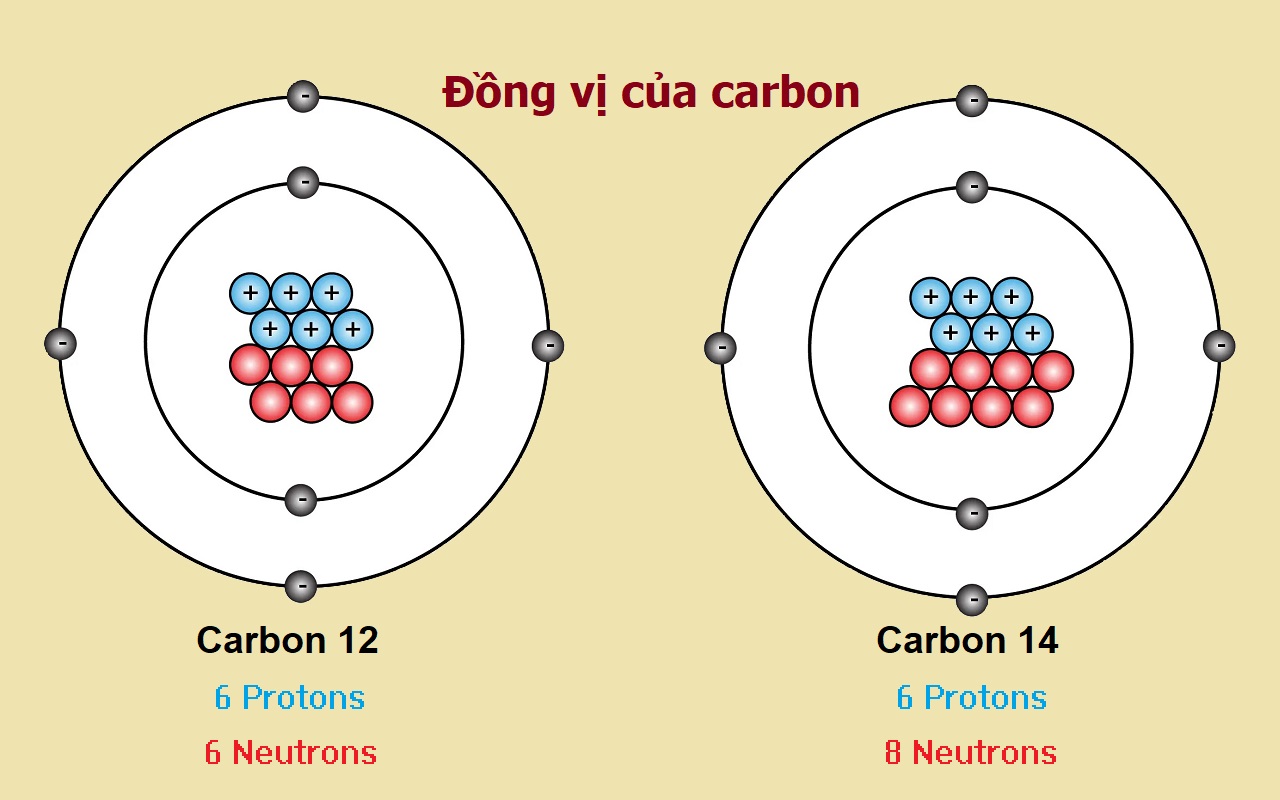
Còn neutron thì sao? Neutron không mang điện tích (trung hòa về điện) và có khối lượng xấp xỉ bằng proton. Điều thú vị là, cùng một nguyên tố (tức là cùng số proton), số lượng neutron trong hạt nhân lại có thể khác nhau. Những "người anh em" này của cùng một nguyên tố, chỉ khác nhau ở số neutron, được gọi là đồng vị. Ví dụ, Carbon phổ biến nhất có 6 proton và 6 neutron (tổng cộng 12 hạt trong hạt nhân), gọi là Carbon-12. Nhưng cũng có Carbon-13 (6 proton, 7 neutron) hay Carbon-14 (6 proton, 8 neutron). Dù số neutron có khác, chúng vẫn là Carbon vì đều có 6 proton.
Vì sự tồn tại của các đồng vị với số neutron khác nhau, nên khối lượng của các nguyên tử cùng một nguyên tố không phải lúc nào cũng y chang nhau. Trong tự nhiên, các nguyên tố thường tồn tại dưới dạng hỗn hợp của nhiều đồng vị khác nhau, mỗi loại có một tỷ lệ "có mặt" nhất định. Do đó, khi nói về khối lượng của một nguyên tố, người ta thường dùng khối lượng nguyên tử trung bình. Con số này được tính bằng cách lấy khối lượng của từng đồng vị nhân với tỷ lệ phần trăm tồn tại của nó trong tự nhiên, rồi cộng tất cả lại. Nó giống như tính điểm trung bình môn học vậy, môn nào có nhiều tiết hơn (tỷ lệ cao hơn) sẽ ảnh hưởng đến điểm trung bình nhiều hơn. Khối lượng nguyên tử trung bình này là con số mà bạn thường thấy trong Bảng Tuần hoàn, và nó phản ánh khối lượng "điển hình" của một nguyên tử nguyên tố đó khi chúng ta gặp nó trong thế giới thực.
Nguyên Tố Có Những Kiểu Gì và Chúng Hoạt Động Ra Sao
Sau khi đã biết nguyên tố là gì, được định nghĩa bằng số proton và có những "anh em" đồng vị, một câu hỏi tự nhiên đặt ra là liệu tất cả chúng có hành xử giống nhau không? Chắc chắn là không rồi! Dù cùng là nguyên tố, mỗi loại lại mang một "tính cách" rất riêng, thể hiện qua cách chúng tương tác với thế giới xung quanh. Bạn có bao giờ thắc mắc tại sao vàng thì cứ lấp lánh mãi không xỉn màu, còn sắt ngoài trời lại dễ dàng bị gỉ sét không? Đó chính là bí mật nằm ở tính chất đặc trưng của từng nguyên tố đấy. Để dễ bề nghiên cứu và hiểu rõ hơn về sự đa dạng đầy màu sắc này, các nhà khoa học đã tìm ra những cách thông minh để nhóm chúng lại. Vậy chúng ta phân loại các nguyên tố dựa trên tiêu chí nào và những đặc điểm nổi bật ấy là gì?
Kim Loại Phi Kim Á Kim Ba Gương Mặt Khác Biệt
Thế giới nguyên tố không phải là một tập hợp đồng nhất. Chúng có những "tính cách" riêng biệt, cho phép chúng ta nhóm lại thành các loại lớn dựa trên đặc điểm chung. Việc phân loại này cực kỳ hữu ích, giúp chúng ta dễ dàng dự đoán và hiểu hành vi của chúng trong các phản ứng hóa học. Ba nhóm chính, chiếm phần lớn bảng tuần hoàn và có ảnh hưởng lớn đến cuộc sống của chúng ta, chính là kim loại, phi kim và á kim.
Kim loại: Những "Đại Gia" Dẫn Điện
Hãy nghĩ đến vàng, bạc, đồng, sắt… Đó là những gương mặt tiêu biểu của nhóm kim loại. Chúng thường có vẻ ngoài sáng bóng, cứng (trừ một số ít như natri, kali hay thủy ngân ở dạng lỏng). Đặc biệt, kim loại nổi tiếng với khả năng dẫn điện và dẫn nhiệt cực tốt – đó là lý do dây điện làm bằng đồng, nồi niêu xoong chảo làm bằng nhôm hoặc inox (hợp kim của sắt và các kim loại khác). Về mặt hóa học, kim loại có xu hướng "hào phóng", dễ dàng nhường electron cho nguyên tố khác để tạo thành ion dương. Đây là lý do chúng rất thích kết hợp với phi kim.
Phi kim: Đa Dạng Và Thích "Gom Góp"
Trái ngược với kim loại, phi kim có vẻ ngoài và trạng thái tồn tại đa dạng hơn nhiều. Có những phi kim là chất khí ở nhiệt độ phòng như oxy, nitơ, clo; có phi kim là chất lỏng như brom; và có những phi kim là chất rắn như carbon, lưu huỳnh, photpho. Chúng thường không dẫn điện (trừ than chì, một dạng của carbon), không có vẻ ngoài sáng bóng và thường giòn nếu ở thể rắn. Về tính cách hóa học, phi kim lại thích "thu gom" electron, nhận về từ kim loại hoặc chia sẻ electron với các phi kim khác để tạo liên kết. Chúng có xu hướng tạo thành ion âm hoặc các phân tử trung hòa.
Á kim: Những "Người Lưỡng Tính" Đầy Thú Vị
Nằm ở ranh giới giữa kim loại và phi kim trên bảng tuần hoàn, á kim là những nguyên tố mang tính chất trung gian. Chúng có thể có vẻ ngoài hơi bóng như kim loại nhưng lại giòn như phi kim. Điểm đặc trưng nhất của á kim là khả năng dẫn điện của chúng nằm ở mức "nửa vời" – chúng là chất bán dẫn. Silicon và Germanium là hai á kim nổi tiếng nhất, đóng vai trò xương sống trong ngành công nghiệp điện tử hiện đại. Tính chất hóa học của á kim cũng "lưỡng tính", có thể thể hiện xu hướng cho hoặc nhận electron tùy thuộc vào nguyên tố mà chúng phản ứng cùng.
Tóm lại, sự phân chia thành kim loại, phi kim và á kim dựa trên sự khác biệt rõ rệt về tính chất vật lý (như độ dẫn điện, trạng thái tồn tại, vẻ ngoài) và đặc biệt là xu hướng hóa học (khả năng cho/nhận electron). Hiểu được ba nhóm này là bạn đã nắm được chìa khóa để giải mã rất nhiều bí ẩn về cách các nguyên tố tương tác và tạo nên thế giới vật chất quanh ta.
Nguyên tố trông thế nào: Những đặc điểm vật lý dễ nhận biết
Ngoài tính cách hóa học riêng biệt, mỗi nguyên tố còn có những đặc điểm vật lý "độc nhất vô nhị", giống như vẻ ngoài và cách "cư xử" của chúng ở điều kiện bình thường. Những đặc điểm này không chỉ giúp ta nhận biết mà còn phân biệt chúng với nhau một cách dễ dàng.
Hãy tưởng tượng bạn gặp một nguyên tố lần đầu tiên. Điều đầu tiên bạn thấy có lẽ là nó ở dạng nào. Ở điều kiện bình thường, tức là nhiệt độ phòng và áp suất khí quyển, hầu hết các nguyên tố tồn tại ở thể rắn. Nghĩ đến sắt, đồng, vàng, hay thậm chí là carbon (than chì, kim cương) – chúng đều là chất rắn quen thuộc. Chỉ có hai nguyên tố là chất lỏng duy nhất: thủy ngân (Hg) và brom (Br). Còn lại, một số ít là chất khí, bao gồm các khí hiếm (như Helium, Neon, Argon), hydro (H₂), nitơ (N₂), oxy (O₂), fluor (F₂), và clo (Cl₂). Trạng thái này là một trong những dấu hiệu đầu tiên để "điểm mặt" một nguyên tố.
Một đặc điểm vật lý quan trọng khác là khả năng chuyển trạng thái khi nhiệt độ thay đổi. Mỗi nguyên tố có một điểm nóng chảy (nhiệt độ chuyển từ rắn sang lỏng) và điểm sôi (nhiệt độ chuyển từ lỏng sang khí) riêng biệt. Những con số này "muôn hình vạn trạng", trải dài từ cực thấp đến cực cao. Helium, một khí hiếm, sôi ở nhiệt độ gần độ không tuyệt đối (-269°C), trong khi vonfram (Tungsten) – kim loại dùng làm dây tóc bóng đèn – lại có điểm nóng chảy cao ngất ngưởng, lên tới 3422°C. Sự khác biệt khổng lồ này là "dấu vân tay" nhiệt độ của từng nguyên tố.
Rồi còn mật độ nữa. Bạn có thể cầm một cục nhôm thấy nhẹ tênh, nhưng nhấc thỏi vàng cùng kích thước thì "trĩu tay". Mật độ cho biết một lượng thể tích nhất định của nguyên tố đó nặng bao nhiêu. Nó phụ thuộc vào khối lượng của các nguyên tử và cách chúng "chen chúc" hay sắp xếp bên trong. Osmi và Iridi là những nguyên tố đặc nhất Trái Đất, trong khi Lithium, Kali lại rất nhẹ.
Cuối cùng, đối với các nguyên tố ở thể rắn, cách các nguyên tử của chúng "xếp hàng" bên trong tạo nên cấu trúc tinh thể. Sắt có thể có cấu trúc khác với đồng, và điều này ảnh hưởng đến nhiều tính chất khác như độ cứng, độ dẻo, hay cách chúng dẫn điện, dẫn nhiệt. Mặc dù không nhìn thấy bằng mắt thường, cấu trúc tinh thể là "bộ khung" định hình nên nhiều đặc tính vật lý bên ngoài của vật liệu.
Tóm lại, từ trạng thái tồn tại, khả năng chịu nhiệt, độ nặng nhẹ cho đến cách các nguyên tử "ngăn nắp" bên trong, tất cả những đặc điểm vật lý này góp phần tạo nên "chân dung" độc đáo của mỗi nguyên tố trong vũ trụ bao la.
Ngôn ngữ và Bản đồ Thế giới Nguyên tố
Sau khi hiểu rõ nguyên tố hóa học là gì và những thuộc tính cơ bản của chúng, câu hỏi đặt ra là làm thế nào để chúng ta nói về chúng một cách ngắn gọn và hiệu quả? Giống như mỗi người có một cái tên và chữ ký riêng, mỗi nguyên tố cũng có ký hiệu và cách biểu diễn thống nhất trên toàn cầu. Thay vì viết dài dòng "sắt", ta chỉ cần dùng ký hiệu "Fe" – một quy ước quốc tế giúp các nhà khoa học khắp nơi dễ dàng giao tiếp. Nhưng không chỉ dừng lại ở ký hiệu, thế giới nguyên tố còn được sắp xếp một cách thiên tài trong "ngôi nhà chung" mang tên Bảng Tuần hoàn, một công cụ quyền năng không chỉ giúp hệ thống hóa mà còn dự đoán tính chất của các nguyên tố. Làm thế nào mà chỉ vài chữ cái và một cái bảng lại có thể tóm gọn cả vũ trụ vật chất và những quy luật chi phối nó?

Danh Tính Của Nguyên Tố Hóa Học
Tưởng tượng mà xem, nếu mỗi nhà khoa học lại gọi nguyên tố theo ý mình thì loạn hết cả lên nhỉ? May mà có một tổ chức "đứng ra làm trọng tài" cho cả thế giới hóa học, đó chính là Liên minh Quốc tế về Hóa học Thuần túy và Ứng dụng, viết tắt là IUPAC. Họ đặt ra một bộ quy tắc cực kỳ quan trọng để đặt tên và "vẽ mặt" cho từng nguyên tố, đảm bảo ai cũng hiểu như nhau.
Cái "vẽ mặt" chính là ký hiệu hóa học đấy. Đơn giản lắm, thường chỉ là một hoặc hai chữ cái thôi. Chữ cái đầu tiên lúc nào cũng viết hoa nhé, còn nếu có chữ thứ hai thì viết thường. Ví dụ như Hydro là H, Oxy là O. Còn Sắt thì sao? Là Fe chứ không phải S hay I đâu nhé (Fe là từ Ferrum trong tiếng Latin). Vàng là Au (từ Aurum). Neon là Ne. Cái ký hiệu này tiện lắm, dùng để viết công thức hóa học hay phương trình phản ứng cho nhanh gọn.
Còn cái tên gọi thì sao? Mỗi nguyên tố có một cái tên chính thức được IUPAC công nhận. Tên này có thể lấy từ đủ thứ nguồn: tên nhà khoa học phát hiện ra nó, tên địa danh nơi nó được tìm ra, hay thậm chí là từ tiếng Latin, tiếng Hy Lạp cổ để mô tả tính chất của nó. Ví dụ như Curium được đặt theo tên vợ chồng Marie và Pierre Curie, Californium đặt theo bang California nơi nó được tổng hợp lần đầu, hay Hydrogen (Hydro) có nghĩa là "tạo ra nước" trong tiếng Hy Lạp.
À, mà khi mới tìm ra một nguyên tố siêu nặng, chưa kịp đặt tên chính thức, IUPAC còn có cách đặt tên "tạm" dựa vào số nguyên tử của nó nữa cơ. Kiểu như Ununoctium (nguyên tố 118) ngày xưa, giờ có tên chính thức là Oganesson rồi.
Nhờ có hệ thống tên gọi và ký hiệu chuẩn này mà các nhà hóa học trên khắp thế giới có thể "nói chuyện" với nhau, viết công thức, phương trình hóa học một cách dễ dàng, không sợ nhầm lẫn. Nó giống như một ngôn ngữ chung vậy đó, giúp cả thế giới cùng hiểu về "bảng chữ cái" của vũ trụ.
Bảng Tuần hoàn: Bộ Sắp Xếp Thiên Tài
Bạn có bao giờ tự hỏi làm thế nào mà các nhà khoa học lại có thể hiểu và dự đoán tính chất của hàng trăm nguyên tố khác nhau? Bí mật nằm ở một công cụ cực kỳ quyền năng và đẹp đẽ: Bảng Tuần hoàn các nguyên tố hóa học. Nó không chỉ là một tấm bảng liệt kê khô khan, mà thực sự là một bản đồ chi tiết, một bộ sắp xếp thiên tài giúp chúng ta nhìn thấy mối liên hệ sâu sắc giữa các thành viên trong vũ trụ nguyên tố.
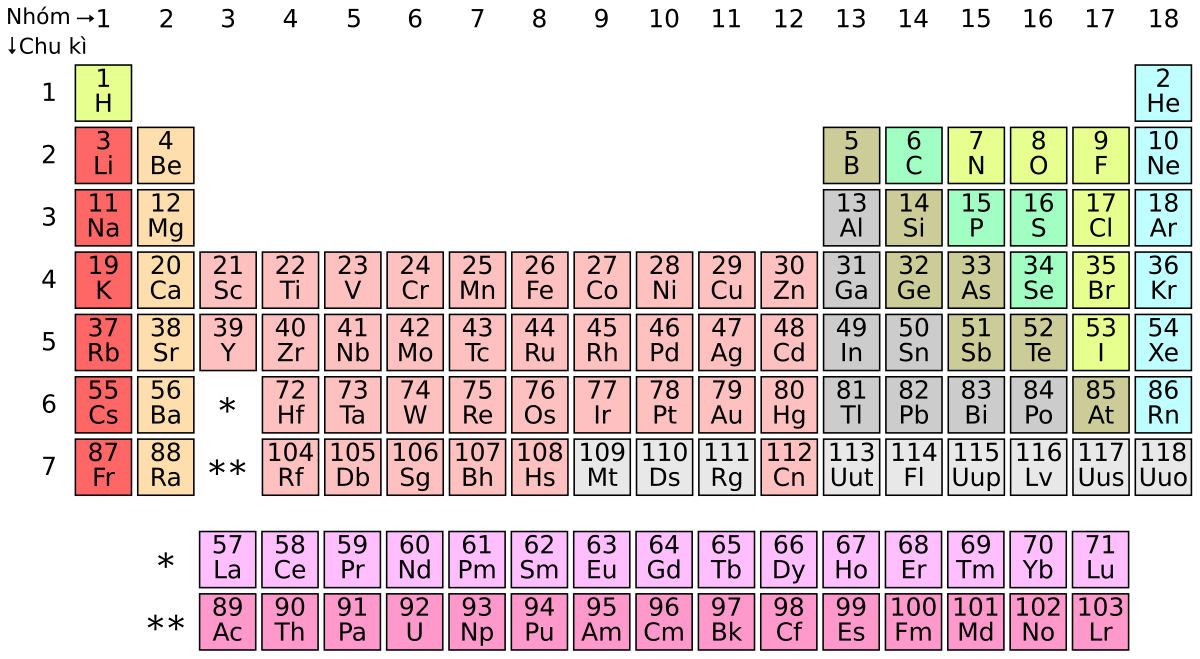
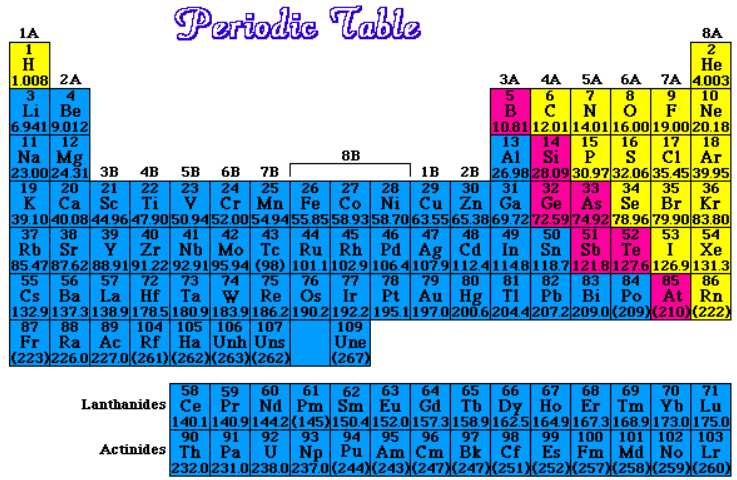
Hãy nhìn vào cấu trúc của nó. Bảng Tuần hoàn được tổ chức theo hai chiều chính: hàng ngang và cột dọc. Các hàng ngang được gọi là chu kỳ. Số thứ tự của chu kỳ (từ 1 đến 7, thậm chí hơn nữa với các nguyên tố mới được tổng hợp) cho biết số lớp electron mà nguyên tử của nguyên tố đó có. Càng xuống dưới, nguyên tử càng có nhiều lớp electron, kích thước thường lớn hơn và tính chất cũng thay đổi dần dần.
Còn các cột dọc thì sao? Chúng được gọi là nhóm. Đây mới là nơi thể hiện rõ nhất sự "họ hàng" của các nguyên tố. Các nguyên tố trong cùng một nhóm thường có số electron hóa trị (electron ở lớp ngoài cùng) giống nhau, và chính điều này quyết định phần lớn tính chất hóa học của chúng. Cứ như có phép màu vậy, các nguyên tố trong cùng một cột dọc lại có xu hướng phản ứng và hành xử theo cách tương tự nhau. Ví dụ, tất cả các nguyên tố nhóm IA (ngoại trừ Hydro) đều là kim loại kiềm rất hoạt động, dễ dàng nhường đi 1 electron.
Ngoài ra, Bảng Tuần hoàn còn được chia thành các khối (s, p, d, f) dựa trên loại obitan mà electron cuối cùng điền vào. Điều này giúp chúng ta hiểu sâu hơn về cấu hình electron của nguyên tử, một yếu tố then chốt quyết định tính chất vật lý và hóa học. Khối s thường chứa kim loại kiềm và kiềm thổ, khối p chứa phi kim, á kim và một số kim loại, khối d là nơi cư ngụ của các kim loại chuyển tiếp đầy màu sắc, còn khối f là nhóm các nguyên tố đất hiếm và actini hiếm gặp.
Nhờ cách sắp xếp thông minh này, Bảng Tuần hoàn trở thành công cụ dự đoán không thể thiếu. Chỉ cần biết vị trí của một nguyên tố trên bảng, bạn có thể suy luận ngay về tính kim loại hay phi kim, mức độ hoạt động hóa học, trạng thái tồn tại, thậm chí là xu hướng tạo liên kết của nó. Nếu bạn biết tính chất của nguyên tố này, bạn có thể dự đoán khá chính xác tính chất của nguyên tố nằm ngay bên cạnh hoặc ngay phía trên/dưới nó. Đó chính là sức mạnh của sự hệ thống hóa và mối quan hệ tuần hoàn! Nó biến một tập hợp các nguyên tố riêng lẻ thành một bức tranh tổng thể, nơi mỗi mảnh ghép đều có vị trí và vai trò riêng, đồng thời liên kết chặt chẽ với những mảnh ghép xung quanh.
Hành trình nguyên tố từ Vũ trụ
Bạn có bao giờ tự hỏi những nguyên tố làm nên mọi thứ xung quanh chúng ta, từ không khí ta hít thở đến chiếc điện thoại ta dùng, từ đâu mà ra không? Câu chuyện về nguồn gốc của chúng kỳ diệu hơn bất kỳ câu chuyện cổ tích nào, bắt đầu từ chính khoảnh khắc vũ trụ khai sinh.

Ngay sau Vụ Nổ Lớn (Big Bang), vũ trụ còn cực kỳ nóng và đặc. Lúc đó, chỉ có những hạt cơ bản tồn tại. Khi vũ trụ giãn nở và nguội đi đôi chút, những hạt này bắt đầu kết hợp lại, tạo ra những nguyên tố nhẹ nhất: Hydro và Heli. Cứ hình dung như vũ trụ sơ sinh chỉ có hai "món" chính này vậy đó, chiếm phần lớn khối lượng vũ trụ cho đến tận bây giờ. Một ít Lithium cũng được tạo ra trong giai đoạn hỗn loạn ban đầu này, nhưng số lượng không đáng kể.
Vậy còn những nguyên tố nặng hơn như Carbon, Oxy, Sắt hay Vàng thì sao? Chúng không có mặt trong "thực đơn" Big Bang. Chính những ngôi sao khổng lồ, rực rỡ trên bầu trời đêm là nơi sản xuất ra chúng. Bên trong lõi sao, dưới áp suất và nhiệt độ khủng khiếp, các nguyên tử Hydro và Heli bị ép lại, hợp nhất với nhau trong một quá trình gọi là phản ứng tổng hợp hạt nhân. Đây chính là lò luyện kim vĩ đại của vũ trụ, biến các nguyên tố nhẹ thành những nguyên tố nặng hơn.
Những ngôi sao có khối lượng nhỏ như Mặt Trời của chúng ta chủ yếu tạo ra các nguyên tố nhẹ hơn Sắt. Nhưng với những ngôi sao cực kỳ to lớn, khi chúng đi đến cuối đời, một điều ngoạn mục xảy ra: chúng phát nổ thành siêu tân tinh. Vụ nổ này giải phóng năng lượng kinh hoàng, đủ sức tạo ra cả những nguyên tố nặng nhất như Vàng, Chì hay Uranium. Rồi vật chất từ vụ nổ siêu tân tinh này văng ra khắp không gian, mang theo "hạt giống" của các nguyên tố nặng.
Cứ thế, qua hàng tỷ năm, bụi và khí giàu các nguyên tố từ những ngôi sao đã chết tụ lại dưới tác dụng của trọng lực, hình thành nên các thế hệ sao mới, các hành tinh, và cả chúng ta nữa. Nghĩ mà xem, nguyên tử Carbon trong cơ thể bạn có thể đã từng là một phần của một ngôi sao khổng lồ cách đây hàng tỷ năm!
Tuy nhiên, các nguyên tố không phân bố đều khắp nơi. Trong vũ trụ, Hydro và Heli vẫn là "ông hoàng, bà chúa". Trên Trái Đất, câu chuyện lại khác. Nhờ quá trình hình thành hành tinh, các nguyên tố nặng hơn có xu hướng tập trung lại. Lõi Trái Đất chủ yếu là Sắt và Niken, còn lớp vỏ và bầu khí quyển lại giàu Oxy, Silic, Nhôm, Sắt… Sự phân bố này tạo nên sự đa dạng địa chất và là nền tảng cho sự sống như chúng ta biết. Mỗi hành tinh, mỗi thiên thể đều có "thành phần" riêng, phản ánh lịch sử hình thành và vị trí của nó trong vũ trụ bao la.
Nguyên tố Một Câu Chuyện Dài Của Khám Phá
Bạn có bao giờ tự hỏi, trước khi có Bảng Tuần hoàn hiện đại, con người đã hình dung về ‘vật chất’ như thế nào không? Phải chăng kiến thức về nguyên tố hóa học mà chúng ta biết ngày nay chỉ xuất hiện ‘bùm’ một cái? Thực tế, hành trình khám phá và định nghĩa nguyên tố là một câu chuyện dài, đầy những bước ngoặt và cả những quan niệm tưởng chừng rất lạ lùng. Chẳng hạn, từng có thời người ta tin rằng vạn vật được tạo nên từ chỉ bốn thứ cơ bản: đất, nước, khí, lửa – một ý tưởng đã tồn tại hàng nghìn năm! Vậy điều gì đã thay đổi? Làm thế nào mà từ những suy tư triết học cổ xưa, chúng ta lại đi đến được định nghĩa chính xác dựa trên hạt nhân nguyên tử như ngày nay? Hãy cùng lật lại từng trang sử để tìm hiểu.
Nguyên tố Từ Ý Tưởng Cổ Đến Hóa Học Mới
Ngày xửa ngày xưa, khi khoa học chưa có những phòng thí nghiệm hiện đại, con người đã bắt đầu tò mò về những thứ tạo nên thế giới xung quanh. Các nhà triết học Hy Lạp cổ đại như Plato và Aristotle đã đưa ra những ý tưởng đầu tiên về các thành phần cơ bản. Họ tin rằng mọi thứ đều được tạo nên từ bốn nguyên tố chính: đất, nước, khí, và lửa. Nghe có vẻ đơn giản quá phải không? Nhưng ở thời đó, đây là một bước tiến lớn, một cách để sắp xếp và hiểu về sự đa dạng của vật chất chỉ bằng suy luận và quan sát. Họ nghĩ rằng sự kết hợp và biến đổi của bốn thứ này đã tạo ra mọi vật chất mà chúng ta thấy.
Tuy nhiên, quan niệm này chủ yếu dựa trên triết học và lý luận, chứ chưa hề có bất kỳ thí nghiệm nào để kiểm chứng. Nó tồn tại suốt hàng nghìn năm, ảnh hưởng sâu sắc đến cả thời kỳ giả kim thuật, nơi người ta mải miết tìm cách biến kim loại rẻ tiền thành vàng, vẫn dựa trên ý tưởng về sự biến đổi của các thành phần cơ bản.
Mãi đến thế kỷ 17, một làn gió mới mang tên khoa học thực nghiệm bắt đầu thổi vào. Robert Boyle, một nhà hóa học và vật lý người Ireland, đã thách thức mạnh mẽ quan niệm cũ. Trong cuốn sách nổi tiếng The Sceptical Chymist (Nhà hóa học hoài nghi), ông đề xuất một định nghĩa hoàn toàn khác cho nguyên tố. Đối với Boyle, nguyên tố không phải là những thứ trừu tượng như đất hay lửa, mà là những chất không thể bị phân hủy thành các chất đơn giản hơn bằng bất kỳ phương pháp hóa học nào đã biết. Đây là một bước ngoặt khổng lồ, chuyển khái niệm nguyên tố từ lĩnh vực triết học sang lĩnh vực hóa học dựa trên thí nghiệm.
Đến cuối thế kỷ 18, Antoine Lavoisier, thường được coi là cha đẻ của hóa học hiện đại, đã đưa định nghĩa của Boyle lên một tầm cao mới. Bằng cách sử dụng cân và các phép đo định lượng chính xác, Lavoisier đã tiến hành vô số thí nghiệm phân hủy và tổng hợp. Ông đã lập ra một danh sách các chất mà ông không thể phân hủy thêm nữa, và gọi chúng là nguyên tố. Danh sách này bao gồm oxy, nitơ, hydro, lưu huỳnh, phốt pho, thủy ngân, kẽm… Dù danh sách của ông còn có cả ánh sáng và nhiệt (những thứ sau này được chứng minh không phải nguyên tố), nhưng cách tiếp cận dựa trên thực nghiệm và định lượng của Lavoisier đã đặt nền móng vững chắc cho khái niệm nguyên tố trong hóa học, mở ra kỷ nguyên khám phá và phân loại các thành phần cơ bản của vũ trụ dựa trên bằng chứng khoa học.
Số Proton: Chìa Khóa Mở Ra Kỷ Nguyên Mới
Ngày xưa, khi hóa học còn non trẻ, người ta cứ loay hoay định nghĩa nguyên tố dựa vào những thứ dễ thấy như tính chất hóa học hay cân nặng của nguyên tử. Nhưng cách này gặp rắc rối lớn khi phát hiện ra những nguyên tử cùng một nguyên tố lại có cân nặng khác nhau (gọi là đồng vị) hoặc khi sắp xếp theo cân nặng không khớp hoàn toàn với tính chất hóa học trong Bảng Tuần hoàn. Cần một cái gì đó bên trong sâu thẳm nguyên tử để định danh chính xác.
Rồi một chàng trai trẻ tài năng tên là Henry Moseley xuất hiện vào đầu thế kỷ 20. Ông ấy làm thí nghiệm cực kỳ khéo léo, dùng tia X để "chiếu" vào các nguyên tố khác nhau. Moseley nhận ra một điều cực kỳ hay ho: tần số của tia X phát ra từ mỗi nguyên tố có mối liên hệ trực tiếp và rất đều đặn với vị trí của nguyên tố đó trong Bảng Tuần hoàn. Hóa ra, thứ thực sự định danh cho một nguyên tố không phải là cân nặng hay tính chất bề ngoài, mà là một con số "đặc trưng" liên quan đến hạt nhân của nó. Con số này, sau này chúng ta gọi là số hiệu nguyên tử (Z), chính là số proton trong hạt nhân!
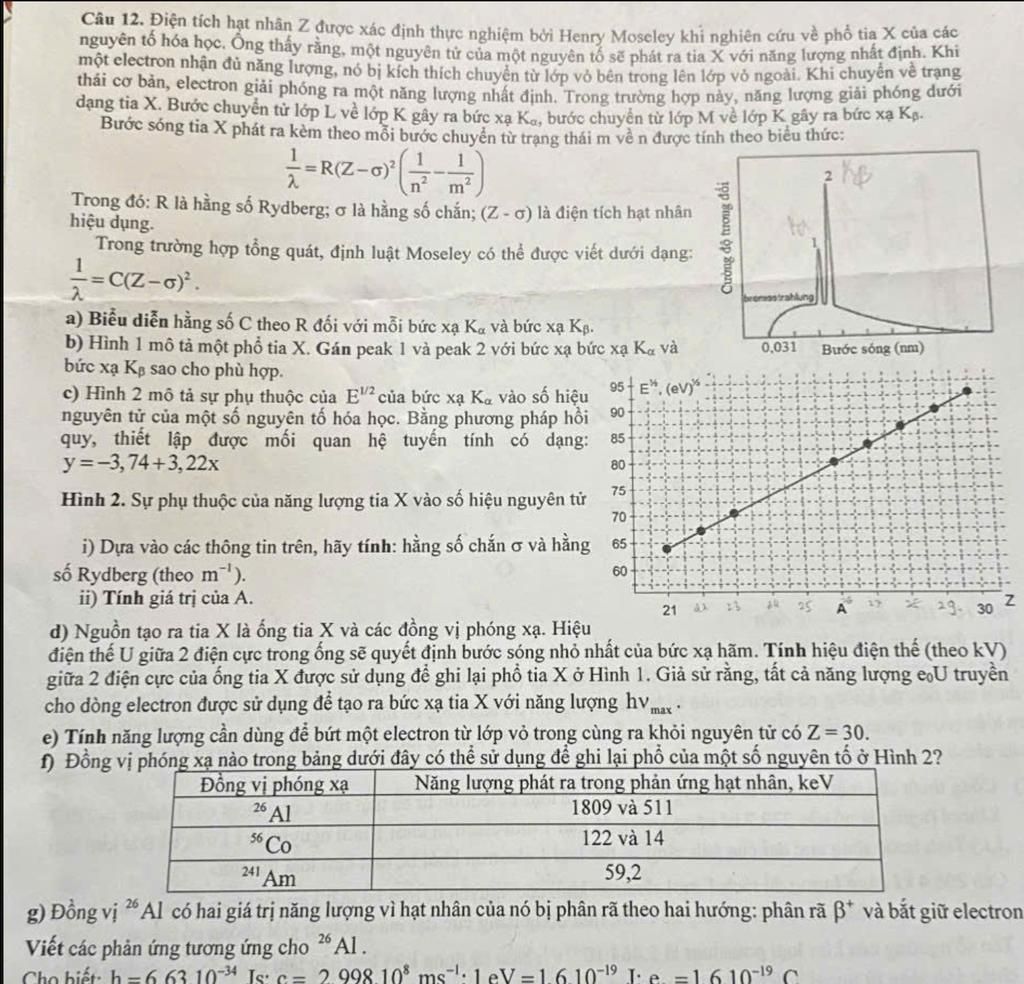
Bước ngoặt này vĩ đại lắm. Nó khẳng định rằng số proton là bản sắc duy nhất và không thể nhầm lẫn của mỗi nguyên tố. Hydro luôn có 1 proton (Z=1), Heli luôn có 2 proton (Z=2), và cứ thế đi lên. Nó giải thích vì sao đồng vị (cùng số proton, khác số neutron) lại có tính chất hóa học giống hệt nhau – vì cái quyết định tính chất hóa học chủ yếu là số electron, mà số electron ở trạng thái trung hòa lại bằng số proton.
Khi đã biết chìa khóa là số proton, cánh cửa đến với những nguyên tố mới bỗng mở toang. Bảng Tuần hoàn được sắp xếp lại một cách khoa học và logic hơn hẳn. Quan trọng hơn, người ta bắt đầu hiểu rằng nếu có thể thay đổi số proton trong hạt nhân, ta có thể biến nguyên tố này thành nguyên tố khác, hoặc thậm chí là tạo ra những nguyên tố chưa từng thấy trong tự nhiên.
Việc tạo ra nguyên tố mới không phải đào đâu đó trong lòng đất nữa. Thay vào đó, người ta dùng những cỗ máy "khủng" gọi là máy gia tốc hạt để bắn những hạt nhân nhẹ hơn vào hạt nhân nặng hơn với tốc độ kinh hoàng. Nếu may mắn và điều kiện phù hợp, hai hạt nhân có thể hợp nhất, tạo ra một hạt nhân mới với số proton bằng tổng số proton của hai hạt nhân ban đầu – một nguyên tố hoàn toàn mới ra đời!
Thế kỷ 20 và 21 là thời kỳ "vàng son" của việc săn lùng và tạo ra các nguyên tố siêu nặng. Đây là những "anh chàng" có số hiệu nguyên tử rất cao, vượt xa những gì tìm thấy tự nhiên trên Trái Đất (thường đến Uranium, Z=92). Các phòng thí nghiệm trên khắp thế giới đã chạy đua để tổng hợp và xác nhận sự tồn tại của những nguyên tố mới, đẩy Bảng Tuần hoàn ngày càng dài thêm. Những "đứa con" mới này thường sống rất ngắn ngủi, chỉ tồn tại trong tích tắc trước khi phân rã, nhưng sự tồn tại của chúng là minh chứng cho sức mạnh của định nghĩa dựa trên hạt nhân và khả năng sáng tạo không ngừng của con người trong việc khám phá thế giới vật chất.
