Mọi thứ xung quanh ta, từ hơi thở trong không khí, chiếc ghế đang ngồi, cho đến những vì sao xa xôi lấp lánh, đều được tạo nên từ những viên gạch vô cùng nhỏ bé mà mắt thường không thể thấy: nguyên tử. Chúng là đơn vị cơ bản nhất của vật chất, nhưng ẩn chứa một cấu trúc phức tạp và những bí mật sâu sắc về cách vũ trụ vận hành. Đã bao giờ bạn tự hỏi, làm thế nào mà những hạt li ti này lại có thể kết hợp để tạo nên sự đa dạng và kỳ diệu của thế giới chúng ta? Hãy cùng nhau vén màn bí ẩn, khám phá hành trình từ cấu tạo cốt lõi đến vai trò không thể thiếu của nguyên tử trong bức tranh rộng lớn của vũ trụ.
Nguyên tử Khái niệm và Cấu tạo
Mọi thứ bạn thấy, chạm vào, ngửi hay nếm đều được tạo nên từ những viên gạch cực kỳ nhỏ bé. Nhỏ đến mức mắt thường chẳng thể nào thấy được. Những viên gạch siêu tí hon ấy chính là nguyên tử. Tưởng tượng bạn cứ chia nhỏ một vật ra mãi, mãi, đến một lúc nào đó bạn sẽ gặp giới hạn mà bằng các phương pháp hóa học thông thường, bạn không thể chia nhỏ hơn được nữa. Đó chính là nguyên tử.

Điều thú vị là, dù nhỏ xíu, nguyên tử không phải là một khối đặc hay đơn giản. Nó có cấu trúc riêng, khá là phức tạp đấy! Và một đặc điểm cực kỳ quan trọng của nguyên tử khi ở trạng thái bình thường là nó trung hòa về điện. Nghĩa là, tổng lượng điện tích dương và tổng lượng điện tích âm bên trong nó cân bằng nhau, triệt tiêu lẫn nhau.
Vậy cấu trúc bên trong ấy gồm những gì mà lại tạo nên sự cân bằng điện diệu kỳ đó? Về cơ bản, nguyên tử được chia làm hai khu vực chính:
Đầu tiên là phần trung tâm, bé tí teo nhưng lại cực kỳ quan trọng, gọi là hạt nhân. Hạt nhân này nằm gọn ở giữa nguyên tử và mang toàn bộ điện tích dương của nó. Giống như mặt trời trong hệ mặt trời vậy, nó là trung tâm thu hút.
Xung quanh hạt nhân là một "đám mây" hay còn gọi là vỏ electron. Khu vực này rộng lớn hơn hạt nhân rất nhiều và là nơi cư ngụ của các hạt mang điện tích âm, gọi là electron. Các electron này không đứng yên mà luôn chuyển động không ngừng quanh hạt nhân, tạo nên cái "vỏ" bao bọc lấy hạt nhân.
Chính sự sắp xếp này – hạt nhân dương ở giữa và các electron âm quay xung quanh – cùng với việc số lượng điện tích dương trong hạt nhân cân bằng với tổng điện tích âm của các electron, đã làm cho nguyên tử trở nên trung hòa về điện. Hiểu rõ khái niệm và cấu tạo cơ bản này chính là chìa khóa để mở cánh cửa vào thế giới kỳ diệu của hóa học và vật lý, nơi nguyên tử là nhân vật chính tạo nên vạn vật.
Những Hạt Nền Tảng Của Nguyên Tử
Tưởng tượng một thế giới tí hon, nơi mọi thứ chúng ta thấy, sờ, ngửi đều được tạo nên từ những viên gạch siêu nhỏ. Viên gạch ấy chính là nguyên tử. Nhưng ngay cả viên gạch này cũng không phải là một khối đặc ruột đâu nhé. Bên trong nó là cả một vũ trụ thu nhỏ với những thành phần cốt lõi cực kỳ quan trọng.
Ở trung tâm của nguyên tử là một "trái tim" bé xíu nhưng cực kỳ nặng và mang điện tích dương. Đó chính là hạt nhân nguyên tử. Hạt nhân này được tạo nên từ hai loại hạt chính: proton và neutron.
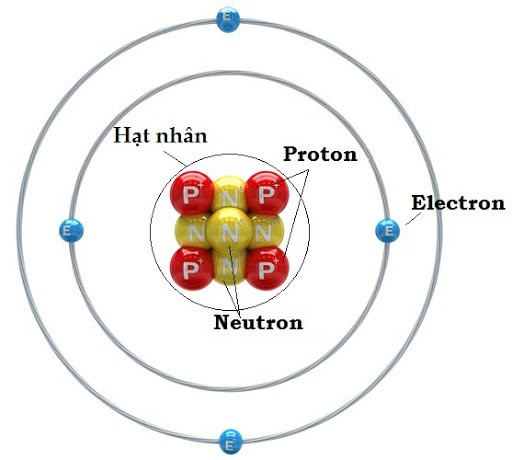
Proton là những hạt mang điện tích dương. Số lượng proton trong hạt nhân chính là "chứng minh thư" của nguyên tử, quyết định nó là nguyên tố hóa học nào – là Oxy, là Sắt, hay là Vàng. Mỗi proton có một khối lượng đáng kể, góp phần lớn vào tổng khối lượng của nguyên tử.
Bên cạnh proton là neutron. Cái tên nói lên tất cả: neutron không mang điện tích, nó trung hòa về điện. Neutron cũng có khối lượng xấp xỉ bằng proton. Vai trò của neutron là giúp "gắn kết" các proton mang điện tích dương lại với nhau trong hạt nhân, ngăn chúng đẩy nhau ra. Số lượng neutron có thể thay đổi trong cùng một loại nguyên tố, tạo ra các "anh em họ hàng" gọi là đồng vị.
Xung quanh hạt nhân nhỏ bé ấy là một "đám mây" rộng lớn hơn rất nhiều, nơi cư ngụ của các electron. Electron là những hạt mang điện tích âm. Khác với proton và neutron nặng nề, electron lại cực kỳ nhẹ, khối lượng của chúng chỉ bằng khoảng 1/1836 khối lượng của một proton.
Electron không đứng yên mà chuyển động không ngừng xung quanh hạt nhân theo những quỹ đạo hoặc vùng không gian xác định, gọi là orbital. Chính sự tương tác hút giữa hạt nhân mang điện dương và electron mang điện âm (lực tĩnh điện) đã giữ cho electron không bay mất, tạo nên cấu trúc bền vững của nguyên tử.
Sự sắp xếp và số lượng của proton, neutron, và electron không chỉ tạo nên cấu trúc nguyên tử mà còn quyết định tất tần tật tính chất của nó. Số proton xác định nguyên tố. Số electron (đặc biệt là các electron ở lớp ngoài cùng) quyết định cách nguyên tử đó sẽ liên kết với các nguyên tử khác để tạo ra phân tử và các chất phức tạp hơn. Khối lượng nguyên tử chủ yếu được tính từ tổng khối lượng của proton và neutron trong hạt nhân. Mọi đặc tính hóa học, vật lý mà chúng ta quan sát được ở các chất đều bắt nguồn từ cách những hạt nền tảng này tương tác với nhau và với môi trường xung quanh.
Nguyên tử Có Gì Đặc Biệt
Nguyên tử không chỉ là những hạt vật chất bé tí xíu tạo nên mọi thứ xung quanh ta, chúng còn có những "tính cách" riêng biệt, những đặc trưng vật lý làm nên sự khác nhau giữa các nguyên tố và quyết định cách chúng tương tác với nhau. Hiểu được những tính chất này giống như việc bạn đang đọc "lý lịch trích ngang" của từng loại nguyên tử vậy đó.
Nặng Nhẹ Thế Nào
Khi nói về nguyên tử, khối lượng là một trong những đặc điểm quan trọng hàng đầu. Nhưng vì chúng quá nhỏ bé, việc dùng đơn vị gam hay kilogam thông thường là cực kỳ bất tiện. Tưởng tượng cân một hạt cát bằng cân tấn thì biết rồi đó! Thế nên, các nhà khoa học đã nghĩ ra một đơn vị riêng, gọi là đơn vị khối lượng nguyên tử, ký hiệu là u (hoặc amu). Đơn vị này dựa trên khối lượng của nguyên tử Carbon-12.
Khối lượng của một nguyên tử chủ yếu tập trung ở hạt nhân, nơi chứa proton và neutron. Mỗi proton và neutron có khối lượng xấp xỉ 1 u. Số khối của nguyên tử chính là tổng số proton và neutron trong hạt nhân, và con số này cho ta một ước lượng khá tốt về khối lượng nguyên tử theo đơn vị u. Ví dụ, một nguyên tử Carbon-12 có 6 proton và 6 neutron, số khối là 12, và khối lượng nguyên tử của nó gần bằng 12 u. Sự khác biệt nhỏ giữa khối lượng thực tế và số khối là do khối lượng của electron (rất nhỏ) và hiệu ứng năng lượng liên kết hạt nhân.
To Nhỏ Ra Sao
Kích thước của nguyên tử cũng là một câu chuyện thú vị. Chúng nhỏ đến mức khó tin, thường được đo bằng đơn vị picomet (pm) hoặc angstrom (Å). Một angstrom bằng một phần mười tỷ mét! Kích thước này thường được mô tả qua bán kính nguyên tử.
Bán kính nguyên tử không phải là một con số cố định như bán kính của một quả bóng bi. Nó phụ thuộc vào nhiều yếu tố, đặc biệt là cách nguyên tử liên kết với các nguyên tử khác. Tuy nhiên, chúng ta vẫn có thể thấy những xu hướng rõ ràng khi nhìn vào Bảng tuần hoàn các nguyên tố. Khi đi xuống một nhóm (cột dọc), bán kính nguyên tử thường tăng lên vì có thêm các lớp electron mới ở xa hạt nhân hơn. Ngược lại, khi đi ngang qua một chu kỳ (hàng ngang) từ trái sang phải, bán kính nguyên tử lại có xu hướng giảm đi. Tại sao ư? Vì số proton trong hạt nhân tăng lên, lực hút của hạt nhân lên các electron lớp ngoài mạnh hơn, kéo chúng lại gần hạt nhân hơn, làm nguyên tử co lại một chút.
Năng Lượng Bên Trong
Các electron trong nguyên tử không di chuyển lung tung mà cư trú ở những "khu vực" hoặc "lớp" năng lượng nhất định xung quanh hạt nhân. Tưởng tượng như những bậc thang trong một tòa nhà, mỗi electron chỉ có thể đứng trên một bậc thang cụ thể, không thể lơ lửng ở giữa. Những khu vực này được gọi là các orbital hoặc lớp electron.
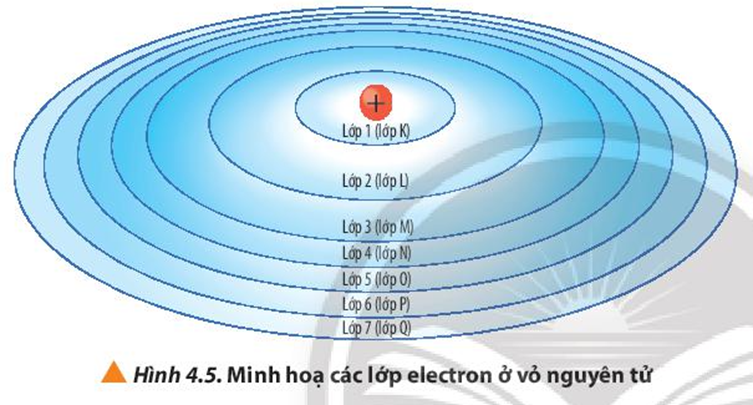
Mỗi orbital có một mức năng lượng đặc trưng. Electron có thể nhảy từ mức năng lượng thấp lên mức năng lượng cao hơn nếu hấp thụ năng lượng (ví dụ: ánh sáng, nhiệt). Ngược lại, khi electron nhảy từ mức năng lượng cao xuống mức thấp hơn, chúng sẽ giải phóng năng lượng dưới dạng ánh sáng. Điều đặc biệt là năng lượng giải phóng này có giá trị rất cụ thể, tương ứng với hiệu năng lượng giữa hai mức đó.
Chính sự "nhảy nhót" năng lượng có quy luật này của electron tạo ra cái gọi là phổ vạch phát xạ hoặc phổ vạch hấp thụ – những "vân tay" ánh sáng độc nhất vô nhị cho từng loại nguyên tố. Khi phân tích ánh sáng phát ra từ một chất khí bị nung nóng (như đèn neon hay ánh sáng sao), chúng ta sẽ thấy những vạch màu riêng biệt, và dựa vào vị trí của các vạch này, các nhà khoa học có thể biết chất khí đó được tạo thành từ những nguyên tố nào. Đây là một công cụ cực kỳ mạnh mẽ để khám phá thành phần của vật chất, dù là trong phòng thí nghiệm hay ở những thiên hà xa xôi.
Câu Chuyện Về Mô Hình Nguyên Tử
Tưởng tượng xem, cách đây hơn hai ngàn năm, con người đã bắt đầu tự hỏi: Mọi thứ được tạo nên từ đâu? Có phải cứ chia nhỏ vật chất mãi thì sẽ đến một lúc không thể chia được nữa không?
Ý Tưởng Ban Đầu Từ Hy Lạp Cổ Đại
Người đầu tiên đưa ra ý tưởng táo bạo này là triết gia Hy Lạp Democritus vào khoảng thế kỷ thứ 5 trước Công nguyên. Ông tin rằng mọi vật chất đều được tạo thành từ những hạt cực nhỏ, không thể phân chia được nữa, và ông gọi chúng là "atomos" (nghĩa là "không thể cắt"). Với Democritus, những hạt "atomos" này là vĩnh cửu, chuyển động không ngừng và khác nhau về hình dạng, kích thước, cách sắp xếp, từ đó tạo nên sự đa dạng của thế giới. Tuy nhiên, đây chỉ là một ý tưởng triết học dựa trên suy luận, không có bằng chứng thực nghiệm nào để chứng minh cả.

Dalton Và Nền Tảng Khoa Học
Mãi đến đầu thế kỷ 19, nhà khoa học người Anh John Dalton mới mang ý tưởng về nguyên tử bước vào thế giới khoa học thực nghiệm. Dựa trên các thí nghiệm về khí và định luật bảo toàn khối lượng, Dalton đưa ra thuyết nguyên tử hiện đại đầu tiên. Ông khẳng định nguyên tố được tạo thành từ các hạt cực nhỏ gọi là nguyên tử, và nguyên tử của cùng một nguyên tố thì giống hệt nhau, khác với nguyên tử của nguyên tố khác. Quan trọng hơn, ông nói rằng nguyên tử không bị phân chia trong các phản ứng hóa học, mà chỉ kết hợp lại theo những tỉ lệ đơn giản để tạo thành hợp chất. Mô hình của Dalton coi nguyên tử như những quả cầu đặc, cứng và không thể phá vỡ.
Khám Phá Electron Của Thomson
Thế nhưng, bức tranh về nguyên tử không dừng lại ở đó. Cuối thế kỷ 19, nhà vật lý J.J. Thomson đã thực hiện các thí nghiệm với ống phóng điện tử chân không (ống tia âm cực). Kết quả thí nghiệm đã dẫn ông đến việc phát hiện ra hạt mang điện âm mà sau này được gọi là electron. Sự tồn tại của electron chứng tỏ nguyên tử có thể bị phân chia, phá vỡ quan niệm "không thể phân chia" của Dalton. Thomson đề xuất mô hình "bánh pudding mận": nguyên tử là một khối cầu mang điện tích dương, trong đó các electron mang điện tích âm được phân bố rải rác như những quả mận trong chiếc bánh.
Mô Hình Hạt Nhân Của Rutherford
Bước ngoặt lớn tiếp theo đến vào đầu thế kỷ 20 với nhà vật lý Ernest Rutherford và các cộng sự. Họ thực hiện thí nghiệm nổi tiếng bắn phá lá vàng mỏng bằng các hạt alpha (hạt nhân heli). Kết quả thật bất ngờ: hầu hết hạt alpha xuyên qua lá vàng như không có gì cản trở, nhưng một số ít bị lệch hướng, thậm chí có hạt bật ngược trở lại. Điều này hoàn toàn mâu thuẫn với mô hình "bánh pudding mận". Rutherford đi đến kết luận: nguyên tử phải có một phần trung tâm rất nhỏ, rất đặc và mang điện tích dương mạnh, gọi là hạt nhân. Các electron mang điện âm chuyển động xung quanh hạt nhân ở một khoảng cách rất xa, khiến phần lớn nguyên tử là không gian trống rỗng. Mô hình này giống như một hệ mặt trời thu nhỏ, với hạt nhân ở trung tâm và electron quay xung quanh.
Bohr Và Các Mức Năng Lượng
Mô hình của Rutherford vẫn còn một số điểm chưa giải thích được, đặc biệt là tại sao electron không bị hút vào hạt nhân và sụp đổ. Nhà vật lý người Đan Mạch Niels Bohr đã áp dụng các ý tưởng từ lý thuyết lượng tử non trẻ vào mô hình của Rutherford. Năm 1913, Bohr đề xuất rằng electron chỉ có thể tồn tại và chuyển động trên những quỹ đạo (hay mức năng lượng) xác định xung quanh hạt nhân, giống như các bậc thang năng lượng. Khi electron nhảy từ mức năng lượng cao xuống mức năng lượng thấp hơn, nó phát ra một lượng năng lượng dưới dạng ánh sáng (photon) có tần số xác định, giải thích được phổ vạch của nguyên tử. Ngược lại, khi hấp thụ năng lượng, electron có thể nhảy lên mức cao hơn.
Bước Sang Cơ Học Lượng Tử
Mô hình của Bohr là một bước tiến quan trọng nhưng vẫn còn hạn chế, chủ yếu chỉ giải thích tốt cho nguyên tử đơn giản như Hydro. Để hiểu sâu hơn về hành vi phức tạp của electron trong các nguyên tử nặng hơn, cần đến sự ra đời của cơ học lượng tử hoàn chỉnh vào những năm 1920 với công lao của các nhà khoa học như Schrödinger, Heisenberg, Dirac… Cơ học lượng tử không còn coi electron là những hạt nhỏ chuyển động trên quỹ đạo xác định nữa, mà mô tả chúng bằng hàm sóng, thể hiện xác suất tìm thấy electron ở một vùng không gian nhất định xung quanh hạt nhân. Khái niệm "quỹ đạo" được thay thế bằng "orbital" – vùng không gian mà electron có khả năng tồn tại cao nhất, tạo nên "đám mây electron". Đây là mô hình nguyên tử phức tạp và chính xác nhất mà chúng ta có hiện nay.
Từ ý tưởng triết học xa xưa đến những mô hình ngày càng tinh vi dựa trên thực nghiệm và toán học lượng tử, hành trình khám phá nguyên tử là minh chứng sống động cho sự phát triển không ngừng của khoa học, luôn tìm cách vén màn những bí ẩn nhỏ bé nhất để hiểu về vũ trụ rộng lớn.
Nguyên Tử Từ Ngôi Sao Xa Đến Vật Quanh Ta
Tưởng tượng xem, dù bạn đang ở đâu, làm gì, thì những hạt vô cùng nhỏ bé gọi là nguyên tử vẫn luôn vây quanh. Chúng là những viên gạch xây nên tất cả mọi thứ trong vũ trụ này, từ không khí bạn hít thở, nước bạn uống, chiếc điện thoại bạn đang cầm, cho đến những ngôi sao lấp lánh xa tít tắp. Nguyên tử có mặt ở khắp mọi nơi, là nền tảng của thế giới vật chất.
Vậy những viên gạch vũ trụ này đến từ đâu? Câu chuyện của chúng bắt đầu từ thuở sơ khai, ngay sau Vụ Nổ Lớn (Big Bang). Khi ấy, vũ trụ còn cực nóng và dày đặc, chỉ có những nguyên tử nhẹ nhất như Hydro và Heli được hình thành. Hàng tỷ năm sau, dưới áp lực và nhiệt độ khủng khiếp bên trong lòng các ngôi sao, những nguyên tử nhẹ này đã kết hợp lại (quá trình tổng hợp hạt nhân sao) để tạo ra các nguyên tử nặng hơn như Carbon, Oxy, Sắt… Khi những ngôi sao khổng lồ này kết thúc vòng đời bằng một vụ nổ siêu tân tinh ngoạn mục, chúng đã rải vật chất – tức là các nguyên tử nặng hơn – khắp không gian, gieo mầm cho sự hình thành các hành tinh và cả sự sống sau này.

Làm sao chúng ta biết được điều này khi nguyên tử lại quá nhỏ bé, mắt thường chẳng thể thấy? Các nhà khoa học đã phát minh ra những công cụ cực kỳ tinh vi. Kính hiển vi điện tử, đặc biệt là loại quét đường hầm (STM) hay truyền qua (TEM), cho phép chúng ta "nhìn thấy" hình ảnh của các nguyên tử hoặc ít nhất là sắp xếp của chúng trên bề mặt vật liệu. Bên cạnh đó, kỹ thuật phổ khối (mass spectrometry) giúp xác định loại nguyên tử nào có mặt trong một mẫu vật bằng cách đo khối lượng của chúng. Nhờ những công cụ này, bức màn bí ẩn về thế giới nguyên tử dần được vén lên.
Những nguyên tử đơn lẻ thì thú vị đấy, nhưng phép màu thực sự xảy ra khi chúng bắt tay nhau. Chính các liên kết hóa học là sợi dây vô hình kết nối các nguyên tử lại với nhau, tạo thành phân tử. Từ những phân tử đơn giản như nước (H₂O) chỉ gồm ba nguyên tử, đến những phân tử khổng lồ, phức tạp như DNA hay protein trong cơ thể chúng ta, tất cả đều được tạo nên từ sự kết hợp khéo léo của các nguyên tử thông qua liên kết hóa học. Sự đa dạng không ngờ của vật chất trong vũ trụ và trên Trái Đất chính là kết quả của vô vàn cách mà các nguyên tử có thể liên kết với nhau. Chúng không chỉ là nền tảng của vật chất, mà còn là động lực đằng sau mọi phản ứng hóa học, mọi quá trình sinh học, và cả những công nghệ tiên tiến nhất mà chúng ta đang sử dụng.
