Thế giới hóa học vô cơ rộng lớn lắm, và oxit axit là một "nhân vật" không thể thiếu. Nghe có vẻ khô khan, nhưng thật ra chúng xuất hiện quanh ta nhiều hơn bạn nghĩ đấy, thậm chí còn là "thủ phạm" gây ra những hiện tượng như mưa axit chẳng hạn. Vậy rốt cuộc oxit axit là gì, làm sao để gọi đúng tên chúng, và những phản ứng hóa học đặc trưng nào khiến chúng trở nên quan trọng đến thế? Nắm vững kiến thức về oxit axit không chỉ giúp bạn hiểu sâu hơn về các loại chất, mà còn là chìa khóa để chinh phục những bài tập hóa học "khó nhằn".
Hiểu Rõ Về Oxit Axit
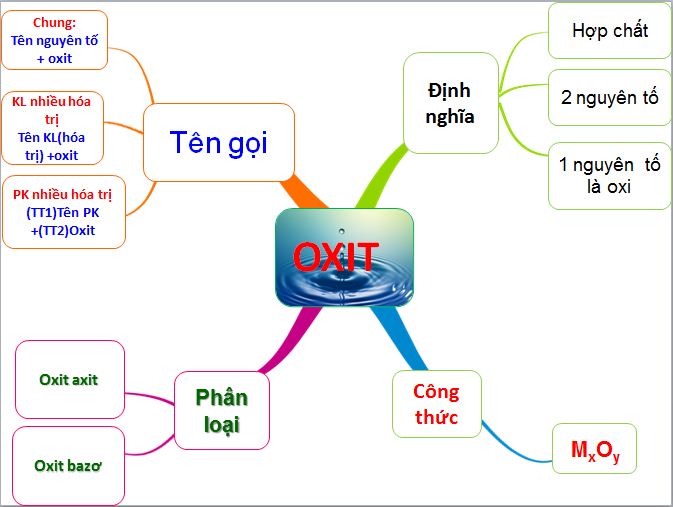
Bạn đã bao giờ nghe đến "oxit axit" chưa? Nghe tên có vẻ hơi "khoa học" một chút, nhưng thực ra khái niệm này khá gần gũi đấy. Đơn giản mà nói, oxit axit là những hợp chất của oxi với một nguyên tố khác, mà khi tan trong nước, chúng lại có khả năng tạo ra axit. Tưởng tượng chúng như những "viên gạch" đặc biệt, sẵn sàng kết hợp với nước để xây nên "ngôi nhà" axit vậy.
Công thức chung của oxit thì muôn hình vạn trạng, nhưng với oxit axit, chúng ta thường gặp dạng EₓOᵧ, trong đó E là nguyên tố "chủ chốt" kết hợp với oxi.
Thường thì, "anh chàng" E này là phi kim. Bạn có thể kể tên ngay vài gương mặt quen thuộc như:
- CO₂ (khí cacbonic): Cái khí mà chúng ta thở ra hàng ngày, hay có trong nước giải khát có gas đấy. Khi tan trong nước, nó tạo ra axit cacbonic yếu.
- SO₂ (lưu huỳnh đioxit): Một loại khí gây ô nhiễm, có mùi hắc. Nó là "thủ phạm" chính gây ra mưa axit khi gặp hơi nước trong không khí.
- P₂O₅ (điphotpho pentaoxit): Một chất rắn màu trắng, có khả năng hút ẩm cực mạnh và khi gặp nước thì phản ứng rất mãnh liệt tạo thành axit photphoric.
- N₂O₅ (đinitơ pentaoxit): Cũng là một oxit của phi kim nitơ, khi tan trong nước sẽ cho ra axit nitric mạnh.
Tuy nhiên, đời không phải lúc nào cũng "thường thì". Có một vài trường hợp hơi "đặc biệt" một chút. Đó là oxit của kim loại nhưng ở hóa trị rất cao, chúng lại thể hiện tính chất của oxit axit. Ví dụ điển hình như:
- CrO₃ (crom(VI) oxit): Đây là oxit của kim loại crom ở hóa trị +6. Nó là chất rắn màu đỏ tươi và khi tan trong nước tạo ra axit cromic.
- Mn₂O₇ (mangan(VII) oxit): Oxit của kim loại mangan ở hóa trị +7. Đây là một chất lỏng màu lục sẫm, không bền và khi gặp nước cũng tạo thành axit (axit permanganic).
Vậy là, dù là oxit của phi kim hay oxit của kim loại hóa trị cao, điểm chung của oxit axit là khả năng sinh ra axit khi phản ứng với nước. Nắm vững khái niệm này sẽ giúp bạn dễ dàng hơn khi tìm hiểu sâu hơn về thế giới hóa học vô cơ đầy màu sắc nhé.
Đặt tên Oxit axit chuẩn xác ai cũng làm được
Đừng lo lắng khi thấy những công thức hóa học "lạ mắt" của oxit axit nhé! Việc gọi tên chúng thực ra cực kỳ đơn giản, chỉ cần bạn nắm vững một vài quy tắc nhỏ xíu thôi. Giống như bạn ghép các miếng lego lại với nhau vậy đó, tên gọi được tạo thành từ các tiền tố chỉ số nguyên tử của phi kim và oxi có trong công thức.
Quy tắc "vàng" ở đây là: Tiền tố chỉ số nguyên tử phi kim + Tên phi kim + Tiền tố chỉ số nguyên tử oxi + oxit.
Nghe có vẻ hơi dài dòng một chút, nhưng khi áp dụng vào ví dụ thì dễ như ăn kẹo ngay. Các tiền tố thường dùng để chỉ số nguyên tử là:
- mono- (một)
- di- (hai)
- tri- (ba)
- tetra- (bốn)
- penta- (năm)
- hexa- (sáu)
- hepta- (bảy)
Có một lưu ý nhỏ nhưng quan trọng nè: Tiền tố mono- thường bị lược bỏ khi nó đứng trước tên phi kim (nghĩa là khi chỉ có 1 nguyên tử phi kim). Nhưng nó vẫn được giữ lại khi đứng trước tên oxi (khi chỉ có 1 nguyên tử oxi).
Áp dụng ngay vào vài ví dụ "kinh điển" nhé:
- CO₂: Có 1 nguyên tử Carbon (phi kim) và 2 nguyên tử Oxi. Theo quy tắc, 1 Carbon thì bỏ mono-, 2 Oxi thì dùng di-. Vậy tên gọi là Carbon dioxit.
- SO₂: Tương tự, 1 Lưu huỳnh (Sulfur) và 2 Oxi. Tên gọi là Lưu huỳnh dioxit (hoặc Sulfur dioxit).
- SO₃: 1 Lưu huỳnh, 3 Oxi (tri-). Tên gọi là Lưu huỳnh trioxit (hoặc Sulfur trioxit).
- N₂O₅: Có 2 nguyên tử Nitơ (Nitrogen) (di-) và 5 nguyên tử Oxi (penta-). Ghép lại ta có đinitơ pentaoxit (hoặc dinitrogen pentoxide).
- P₂O₅: 2 nguyên tử Photpho (Phosphorus) (di-) và 5 nguyên tử Oxi (penta-). Tên gọi là điphotpho pentaoxit (hoặc diphosphorus pentoxide).
- CO: 1 Carbon, 1 Oxi. 1 Carbon bỏ mono-, nhưng 1 Oxi thì vẫn giữ mono-. Tên gọi là Carbon monoxit.
Thấy chưa, đâu có khó gì đâu! Chỉ cần nhìn vào công thức, đếm số lượng nguyên tử của mỗi loại và tra bảng tiền tố là xong ngay. Cứ luyện tập vài lần là bạn sẽ thành thạo ngay thôi!
Oxit axit phản ứng thế nào?
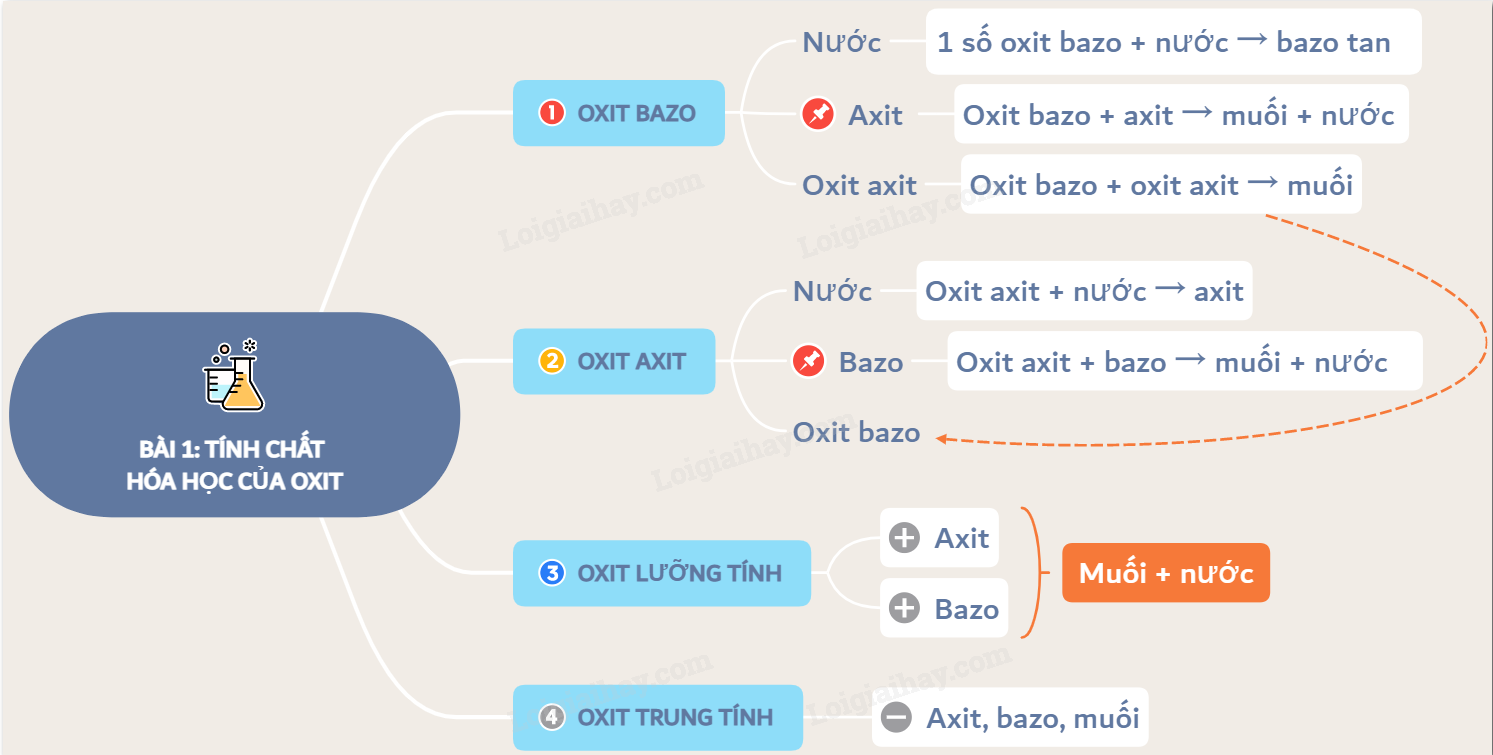
Sau khi làm quen với khái niệm và cách gọi tên, giờ là lúc chúng ta cùng "mổ xẻ" xem oxit axit thể hiện bản thân trong thế giới hóa học ra sao. Bạn có bao giờ thắc mắc tại sao khí thải công nghiệp chứa SO2 lại là một trong những "thủ phạm" gây ra hiện tượng mưa axit đáng sợ không? Bí mật nằm ở chính những tính chất hóa học đặc trưng của chúng đấy! Oxit axit rất "năng động", chúng sẵn sàng "bắt tay" với nước, "đối đầu" với dung dịch bazơ hay "kết hợp" cùng các oxit bazơ tan để tạo nên những sản phẩm mới toanh. Đôi khi, kết quả của cuộc "gặp gỡ" này còn phụ thuộc vào "tâm trạng" hay đúng hơn là tỉ lệ lượng chất tham gia nữa cơ.
Khi Oxit axit gặp Nước
Tưởng tượng nhé, khi mấy anh chàng oxit axit này mà "gặp" nước, một phản ứng khá thú vị thường xảy ra. Hầu hết các oxit axit tan được trong nước sẽ nhanh chóng kết hợp với phân tử nước để tạo ra một "sản phẩm" mới toanh, chính là dung dịch axit tương ứng. Kiểu như SO₂ gặp nước thì "biến hình" thành axit sunfurơ (H₂SO₃) vậy đó. Hay CO₂ quen thuộc trong không khí, khi tan vào nước mưa sẽ tạo ra axit cacbonic (H₂CO₃) yếu.
Phản ứng này cực kỳ quan trọng vì nó là cách chính để tạo ra nhiều loại axit trong phòng thí nghiệm hoặc thậm chí trong tự nhiên. Ví dụ điển hình là:
SO₂ + H₂O → H₂SO₃
CO₂ + H₂O → H₂CO₃
P₂O₅ + 3H₂O → 2H₃PO₄
Cứ mỗi oxit axit sẽ cho ra một loại axit "đặc trưng" của nó. Tuy nhiên, trong cái thế giới hóa học muôn màu này, lúc nào cũng có những trường hợp "ngoại lệ" làm ta phải chú ý một chút. Một ví dụ điển hình là silic đioxit (SiO₂), hay còn gọi là cát. Dù nó là oxit của phi kim, nhưng anh chàng này lại cực kỳ "lạnh lùng" với nước. Ở điều kiện thường, SiO₂ chẳng thèm phản ứng với nước đâu nhé. Đây là điểm cần nhớ để không bị nhầm lẫn khi gặp phải.
Vậy là, quy tắc chung là oxit axit + nước = axit, nhưng đừng quên những "anh chàng" đặc biệt không tuân theo luật chơi này ở điều kiện thông thường nha.
Oxit axit và Bazơ tan Phản ứng Tỉ lệ Quyết Định Tất Cả
Khi oxit axit "gặp gỡ" các dung dịch bazơ tan, hay còn gọi là kiềm, một phản ứng hóa học thú vị sẽ xảy ra. Tưởng chừng đơn giản chỉ là tạo ra muối và nước, nhưng thực tế lại phức tạp hơn một chút, đặc biệt là với những oxit axit có khả năng tạo ra nhiều loại muối khác nhau như CO₂, SO₂, P₂O₅. Mấu chốt ở đây chính là tỉ lệ lượng oxit axit và lượng bazơ tham gia phản ứng.
Tùy vào việc bạn cho bao nhiêu oxit axit tác dụng với bao nhiêu bazơ, sản phẩm tạo thành có thể là muối trung hòa, muối axit, hoặc thậm chí là hỗn hợp của cả hai loại muối này.
Hãy lấy ví dụ với khí cacbonic (CO₂) và dung dịch natri hiđroxit (NaOH).
-
Nếu lượng NaOH ít, chỉ đủ để phản ứng theo tỉ lệ 1:1 với CO₂, bạn sẽ thu được muối axit natri hiđrocacbonat (NaHCO₃):
CO₂ + NaOH → NaHCO₃
Lúc này, chỉ một phần nguyên tử hiđro trong axit cacbonic (H₂CO₃ – axit tương ứng của CO₂) bị thay thế bởi natri. -
Nếu lượng NaOH nhiều, đủ để phản ứng theo tỉ lệ 1:2 với CO₂, bạn sẽ thu được muối trung hòa natri cacbonat (Na₂CO₃):
CO₂ + 2NaOH → Na₂CO₃ + H₂O
Ở đây, tất cả nguyên tử hiđro có thể thay thế trong axit cacbonic đều đã bị thay thế bởi natri. -
Thế còn nếu tỉ lệ NaOH nằm ở giữa 1:1 và 1:2 so với CO₂ thì sao? Đơn giản thôi, bạn sẽ thu được hỗn hợp cả hai loại muối: NaHCO₃ và Na₂CO₃. Lượng bazơ không đủ để chuyển hết thành muối trung hòa, nhưng cũng nhiều hơn mức chỉ tạo muối axit.
Quy tắc tương tự cũng đúng với các cặp oxit axit và bazơ tan khác, ví dụ như lưu huỳnh đioxit (SO₂) tác dụng với kali hiđroxit (KOH) tạo ra KHSO₃ (muối axit) hoặc K₂SO₃ (muối trung hòa) tùy tỉ lệ.
Việc xác định đúng sản phẩm dựa vào tỉ lệ mol này là cực kỳ quan trọng trong việc giải các bài tập hóa học liên quan đến oxit axit tác dụng với dung dịch bazơ. Nó đòi hỏi bạn phải "đong đếm" cẩn thận lượng chất tham gia để dự đoán chính xác "thành quả" thu được sau phản ứng.
Oxit axit kết hợp cùng Oxit bazơ tan
Ngoài việc "bắt tay" với nước hay dung dịch bazơ, các oxit axit còn có một khả năng đặc biệt nữa: phản ứng trực tiếp với những anh chàng oxit bazơ tan được trong nước. Tưởng tượng như hai thái cực đối lập gặp nhau vậy, một bên mang tính axit, một bên mang tính bazơ mạnh mẽ, khi kết hợp lại sẽ tạo ra một sản phẩm "trung hòa", đó chính là muối.
Nhớ nhé, không phải oxit bazơ nào cũng phản ứng được kiểu này ở điều kiện thường đâu. Chỉ những oxit của kim loại kiềm (như Na2O, K2O) và một số kim loại kiềm thổ (như CaO, BaO) mới đủ "sức" để tham gia phản ứng trực tiếp với oxit axit mà không cần môi trường nước.
Phản ứng này khá đơn giản, chỉ là sự "ghép đôi" giữa oxit axit và oxit bazơ để tạo thành một loại muối duy nhất. Cùng xem vài ví dụ minh họa cho dễ hình dung nha:
-
Khi khí cacbonic (CO2), một oxit axit quen mặt, gặp canxi oxit (CaO) hay còn gọi là vôi sống, chúng sẽ tạo ra canxi cacbonat (CaCO3), thành phần chính của đá vôi:
CO2 + CaO → CaCO3 -
Nếu cho lưu huỳnh đioxit (SO2) phản ứng với natri oxit (Na2O), sản phẩm thu được là natri sunfit:
SO2 + Na2O → Na2SO3 -
Hay phức tạp hơn một chút, oxit photpho (P2O5) khi kết hợp với bari oxit (BaO) sẽ tạo ra bari photphat:
P2O5 + 3BaO → Ba3(PO4)2 -
Và tất nhiên, oxit axit cũng phản ứng ngon lành với kali oxit (K2O). Ví dụ, lưu huỳnh trioxit (SO3) và K2O sẽ cho ra kali sunfat:
SO3 + K2O → K2SO4
Đây là một tính chất quan trọng giúp chúng ta hiểu rõ hơn về cách oxit axit tương tác trong thế giới hóa học vô cơ. Nó cho thấy bản chất "chua" của oxit axit có thể được "trung hòa" bởi bản chất "kiềm" của oxit bazơ tan, tạo nên những hợp chất muối quen thuộc.
Oxit axit Vị trí trong gia đình oxit
Trong thế giới hóa học vô cơ rộng lớn, các loại oxit không hề giống nhau. Chúng như những thành viên trong một "gia đình" lớn, mỗi người một tính cách, một vai trò riêng biệt. Để hiểu rõ hơn về oxit axit, chúng ta cần đặt nó vào bức tranh tổng thể này, so sánh với những "người anh em" khác là oxit bazơ, oxit lưỡng tính và oxit trung tính. Chính sự khác biệt này làm nên vị trí đặc biệt của oxit axit.
Hãy xem xét oxit bazơ trước. Đây là những anh chàng đối lập hoàn toàn với oxit axit. Nếu oxit axit thường là oxit của phi kim và khi tan trong nước tạo ra axit, thì oxit bazơ lại thường là oxit của kim loại. Khi những oxit bazơ tan được trong nước, chúng lại sinh ra dung dịch bazơ (hay còn gọi là kiềm). Và tất nhiên, trong phản ứng, oxit axit "thích" tác dụng với bazơ, còn oxit bazơ lại "thích" tác dụng với axit để tạo thành muối và nước. Sự đối lập này giống như hai cực nam châm, hút nhau để trung hòa.
Tiếp đến là oxit lưỡng tính. Thành viên này có tính cách khá "linh hoạt", hay nói vui là "hai mặt". Oxit lưỡng tính có thể tác dụng được cả với dung dịch axit lẫn dung dịch bazơ, đều tạo ra muối và nước. Trong khi đó, oxit axit chỉ thể hiện tính chất "axit" của mình, chỉ phản ứng trực tiếp với bazơ hoặc tan trong nước tạo axit rồi axit đó mới phản ứng với bazơ. Rõ ràng, oxit lưỡng tính đa năng hơn trong khả năng phản ứng.
Cuối cùng là oxit trung tính. Đây có lẽ là thành viên "thờ ơ" nhất trong gia đình oxit. Ở điều kiện thường, oxit trung tính hầu như không phản ứng với nước, axit hay bazơ. Chúng đứng ngoài cuộc chơi của những phản ứng tạo axit hay bazơ mà chúng ta thường thấy. Ngược lại, oxit axit lại khá "năng động", sẵn sàng phản ứng với nước (trừ vài trường hợp đặc biệt như SiO2) và đặc biệt là với các dung dịch bazơ.
Nhìn vào bức tranh này, ta thấy oxit axit nổi bật lên với vai trò là "người bạn" của axit. Tính chất đặc trưng nhất của nó là khả năng tạo ra axit khi gặp nước (đa số) và phản ứng với bazơ để tạo muối. Vị trí của nó được định hình bởi chính những phản ứng đặc trưng này, khác biệt hoàn toàn với khả năng tạo bazơ của oxit bazơ, tính "lưỡng tính" của oxit lưỡng tính hay sự "trung tính" của oxit trung tính. Chính những khác biệt này giúp chúng ta dễ dàng nhận diện và phân loại oxit axit trong thế giới hóa học đầy màu sắc.
Oxit Axit: Ứng Dụng Thực Tế và Bí Kíp Giải Bài Tập
Hóa học không chỉ nằm trong sách vở hay phòng thí nghiệm đâu, nó hiện diện ngay trong cuộc sống hàng ngày của chúng ta đấy. Và oxit axit, dù nghe có vẻ khô khan, lại đóng vai trò không nhỏ trong nhiều hiện tượng tự nhiên lẫn các bài toán "hack não" mà bạn vẫn thường gặp.
Một trong những ứng dụng, hay đúng hơn là hệ quả đáng chú ý nhất của oxit axit, chính là mưa axit. Chắc hẳn bạn đã từng nghe về nó rồi đúng không? Các loại khí thải từ công nghiệp, giao thông như lưu huỳnh đioxit (SO₂) hay nitơ đioxit (NO₂) bay vào khí quyển. Chúng chính là những oxit axit điển hình. Khi gặp hơi nước và các chất khác trong không khí, chúng phản ứng tạo thành axit sulfuric (H₂SO₄) và axit nitric (HNO₃). Những axit này hòa tan trong nước mưa, khiến nước mưa có độ pH thấp hơn bình thường, tạo nên hiện tượng mưa axit. Mưa axit là "kẻ thù" của môi trường, nó làm ăn mòn các công trình kiến trúc, phá hủy rừng cây, ảnh hưởng nghiêm trọng đến nguồn nước và đời sống thủy sinh. Hiểu về oxit axit giúp chúng ta nhận thức rõ hơn về tác động của ô nhiễm không khí.

Bên cạnh những ứng dụng (hoặc hệ quả) thực tế đó, oxit axit còn là "nhân vật chính" trong rất nhiều bài tập hóa học, đặc biệt là các bài toán liên quan đến phản ứng với dung dịch bazơ hoặc oxit bazơ tan. Đừng lo lắng nếu bạn thấy những bài tập này hơi "xoắn não" một chút, bí kíp để chinh phục chúng nằm ở việc nắm chắc tỉ lệ mol!
Khi một oxit axit như CO₂ hay SO₂ tác dụng với dung dịch bazơ như NaOH hay Ca(OH)₂, sản phẩm tạo thành không phải lúc nào cũng giống nhau. Nó phụ thuộc hoàn toàn vào tỉ lệ số mol giữa oxit axit và bazơ. Ví dụ, CO₂ tác dụng với NaOH có thể tạo ra muối axit (NaHCO₃) hoặc muối trung hòa (Na₂CO₃), hoặc thậm chí là hỗn hợp cả hai.
Mấu chốt để giải quyết dạng bài tập này là:
- Viết đầy đủ các phương trình phản ứng có thể xảy ra. Với CO₂ và NaOH, sẽ có hai phương trình tương ứng với tạo muối axit và tạo muối trung hòa.
- Tính số mol của các chất tham gia phản ứng.
- Lập tỉ lệ mol giữa bazơ (thường tính theo nhóm OH⁻ hoặc chính bazơ) và oxit axit. Ví dụ, với CO₂ và NaOH, bạn có thể lập tỉ lệ T = n_NaOH / n_CO₂.
- Dựa vào tỉ lệ này để xác định sản phẩm. Ví dụ, nếu T ≤ 1, chỉ tạo muối axit. Nếu T ≥ 2, chỉ tạo muối trung hòa. Nếu 1 < T < 2, tạo cả hai muối.
- Sử dụng tỉ lệ mol và các phương trình phản ứng để tính toán lượng chất cần tìm theo yêu cầu đề bài.
Việc nắm vững cách lập và biện luận tỉ lệ mol này không chỉ giúp bạn giải "ngon ơ" các bài tập về oxit axit tác dụng với bazơ, mà còn xây dựng nền tảng vững chắc cho nhiều dạng bài tập hóa học khác nữa đấy. Từ những hiện tượng môi trường gần gũi đến những phép tính toán học trong bài kiểm tra, oxit axit luôn có cách để thể hiện vai trò của mình!
