Imagine trying to tell the difference between a tiny speck of gold and a tiny speck of iron. Cả hai đều là kim loại, đều lấp lánh, nhưng chúng lại khác nhau hoàn toàn về tính chất. Điều gì tạo nên sự khác biệt cốt lõi đó? Hóa học hiện đại cho chúng ta biết rằng mọi vật chất quanh ta, từ không khí ta hít thở đến chiếc điện thoại ta cầm, đều được tạo nên từ những "viên gạch" cơ bản gọi là nguyên tố. Và mỗi nguyên tố lại có một "mã định danh" riêng, một con số bí ẩn nhưng cực kỳ quan trọng. Con số ấy chính là số hiệu nguyên tử, hay còn gọi là Z. Nó không chỉ đơn thuần là một con số trên bảng tuần hoàn, mà còn là chìa khóa giải mã cấu trúc bên trong của nguyên tử, quyết định nó là nguyên tố nào và hành xử ra sao trong thế giới hóa học. Bạn có bao giờ tự hỏi, chỉ một con số nhỏ bé lại có thể định hình nên toàn bộ tính chất của một nguyên tố, từ đó tạo nên sự đa dạng kỳ diệu của vũ trụ vật chất này không?
Số hiệu nguyên tử Z: Con số trong tim nguyên tử
Tưởng tượng mỗi nguyên tố hóa học trong vũ trụ này đều có một "chứng minh thư" riêng, một con số định danh độc nhất vô nhị. Đó chính là số hiệu nguyên tử, được ký hiệu bằng chữ Z. Con số này không phải ngẫu nhiên mà có, nó ẩn chứa bí mật về cấu tạo sâu thẳm nhất của nguyên tử.
Số hiệu nguyên tử Z chính là tổng số đơn vị điện tích dương tập trung tại hạt nhân của nguyên tử. Hạt nhân, cái "trái tim" bé xíu nằm ở trung tâm, mang điện tích dương là nhờ sự góp mặt của những hạt hạ nguyên tử đặc biệt: các proton. Mỗi proton mang một đơn vị điện tích dương cơ bản.
Và đây là mối liên hệ cốt lõi, là "chìa khóa" để hiểu về Z: Số hiệu nguyên tử Z chính xác bằng số lượng proton có trong hạt nhân nguyên tử đó. Dù nguyên tử có ở trạng thái nào đi nữa, số proton trong hạt nhân của một nguyên tố cụ thể luôn không đổi, và con số này chính là Z. Nó là bản sắc không thể nhầm lẫn của nguyên tố.
Thế còn electron thì sao? Electron là những hạt mang điện tích âm, "bay lượn" xung quanh hạt nhân. Trong một nguyên tử ở trạng thái "bình thường", tức là trung hòa về điện (không mang điện tích tổng thể), tổng điện tích dương của hạt nhân phải cân bằng với tổng điện tích âm của các electron. Vì điện tích dương là do proton (số lượng là Z), nên để trung hòa, số electron phải bằng với số proton. Do đó, trong một nguyên tử trung hòa, số electron cũng bằng số hiệu nguyên tử Z.
Tóm lại, số hiệu nguyên tử Z là con số "định danh" của nguyên tố, bằng số proton trong hạt nhân. Con số proton này quyết định điện tích dương của hạt nhân. Và trong trường hợp nguyên tử trung hòa, số electron cũng "ăn theo" bằng Z để giữ cân bằng điện. Z chính là nền tảng để phân biệt nguyên tố này với nguyên tố khác.
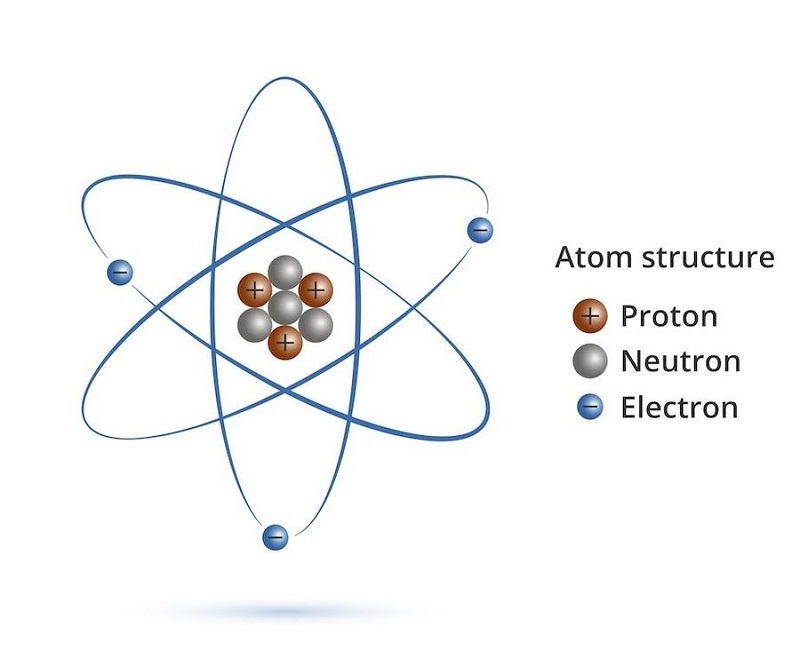
Bộ ba nguyên tử: Z, A, N kết nối thế nào
Sau khi biết Số hiệu nguyên tử (Z) là "chứng minh thư" của mỗi nguyên tố, là số proton trong hạt nhân (và số electron nếu nguyên tử trung hòa điện), thì còn những con số nào quan trọng nữa nhỉ? Đó chính là Số khối (A) và Số nơtron (N). Ba anh em Z, A, N này có mối liên hệ cực kỳ chặt chẽ, giúp chúng ta hiểu rõ hơn về "cân nặng" và cấu tạo bên trong của hạt nhân nguyên tử.
Số khối, ký hiệu là A, đơn giản là tổng số "hạt nặng" trong hạt nhân nguyên tử. Mà hạt nặng trong hạt nhân thì chỉ có proton và nơtron thôi. Vì vậy, ta có công thức cực kỳ cơ bản:
A = Z + N
Công thức này nói lên rằng, lấy số proton (Z) cộng với số nơtron (N) sẽ ra số khối (A). Ngược lại, nếu biết số khối và số hiệu nguyên tử, bạn hoàn toàn có thể tìm ra số nơtron bằng phép trừ đơn giản:
N = A – Z
Ví dụ nhé, nguyên tử Carbon thông thường có Z = 6 và A = 12. Áp dụng công thức, số nơtron của nó sẽ là N = 12 – 6 = 6. Dễ như ăn kẹo phải không nào? Hay như nguyên tử Oxy có Z = 8 và A = 16, thì số nơtron là N = 16 – 8 = 8.
À, nhưng khoan đã! Z luôn là số proton, và nó không bao giờ thay đổi đối với một nguyên tố nhất định. Carbon luôn có Z=6, Oxy luôn có Z=8, dù chúng có ở dạng nào đi chăng nữa. Tuy nhiên, câu chuyện về số electron lại hơi khác một chút, đặc biệt khi nguyên tử biến thành ion.
Nhớ lại, ở trạng thái trung hòa điện, số electron bằng số proton (Z). Nhưng khi nguyên tử nhường hoặc nhận electron, nó sẽ trở thành ion mang điện tích.
- Nếu nguyên tử mất electron, nó sẽ có nhiều proton dương hơn electron âm, trở thành ion dương (cation). Lúc này, số electron ít hơn Z.
- Nếu nguyên tử nhận electron, nó sẽ có nhiều electron âm hơn proton dương, trở thành ion âm (anion). Lúc này, số electron nhiều hơn Z.
Điều quan trọng cần gạch chân ở đây là: Dù nguyên tử là trung hòa hay đã "biến hình" thành ion, thì Số hiệu nguyên tử (Z) vẫn không hề thay đổi. Z chỉ phụ thuộc vào số proton trong hạt nhân, và số proton chính là thứ định danh nguyên tố. Số electron có thể "nhảy múa" tùy theo trạng thái ion hóa, nhưng Z thì luôn đứng vững như một cột mốc cố định.
Số hiệu nguyên tử: Chìa khóa Định danh và Tính chất
Bạn biết không, mỗi nguyên tố hóa học trong vũ trụ này đều có một "chứng minh thư" riêng, một con số độc nhất vô nhị mà không ai khác có được. Đó chính là số hiệu nguyên tử, hay còn gọi là Z. Con số này không chỉ đơn thuần là một nhãn dán, mà nó chính là cốt lõi định danh của nguyên tố đó.

Tại sao lại nói Z là cốt lõi? Đơn giản lắm, vì Z cho bạn biết chính xác có bao nhiêu hạt proton trong hạt nhân của nguyên tử. Và chính số lượng proton này mới là thứ quyết định bạn đang nói về nguyên tố nào. Một nguyên tử có 6 proton? Chắc chắn đó là Carbon (C). Có 8 proton? Chắc chắn là Oxygen (O). Không thể nhầm lẫn được! Dù nguyên tử đó có bao nhiêu nơtron hay electron đi chăng nữa, số proton (tức Z) luôn là dấu hiệu nhận biết không thể chối cãi.
Nhưng Z không chỉ dừng lại ở việc định danh. Nó còn là người kiến tạo nên "tính cách" của nguyên tố. Hãy nghĩ xem, trong một nguyên tử trung hòa về điện, số electron luôn bằng số proton, tức là bằng Z. Và chính cách mà những electron này sắp xếp xung quanh hạt nhân – cái mà chúng ta gọi là cấu hình electron – lại là yếu tố then chốt quyết định nguyên tố đó sẽ "cư xử" thế nào trong thế giới hóa học.
Cấu hình electron giống như bản thiết kế hành vi của nguyên tử vậy. Nó cho biết nguyên tử dễ dàng nhường, nhận hay góp chung electron với nguyên tử khác ra sao. Điều này trực tiếp ảnh hưởng đến khả năng tạo liên kết hóa học, tính kim loại hay phi kim, độ hoạt động hóa học, và vô vàn tính chất đặc trưng khác của nguyên tố. Ví dụ, các nguyên tố có Z khiến lớp electron ngoài cùng chỉ có 1 electron (như Natri với Z=11) thường rất dễ nhường đi electron này và có tính kim loại mạnh. Ngược lại, những nguyên tố có Z khiến lớp ngoài cùng gần đầy electron (như Clo với Z=17) lại có xu hướng nhận thêm electron và có tính phi kim mạnh.
Và đây là điểm thú vị cuối cùng: Số hiệu nguyên tử Z chính là nguyên tắc sắp xếp vĩ đại của Bảng tuần hoàn các nguyên tố hóa học. Bảng tuần hoàn mà chúng ta học chính là sự sắp xếp các nguyên tố theo chiều tăng dần của Z. Sự sắp xếp này không phải ngẫu nhiên, mà nó phản ánh một quy luật sâu sắc: các nguyên tố có cấu hình electron tương tự nhau (và do đó có tính chất hóa học tương tự nhau) thường xuất hiện định kỳ và được xếp vào cùng một cột (nhóm). Nhờ có Z, chúng ta mới có một bản đồ hóa học logic và đầy đủ như ngày nay, giúp dự đoán tính chất của những nguyên tố thậm chí còn chưa được khám phá lúc bấy giờ.
Tóm lại, số hiệu nguyên tử Z không chỉ là con số định danh, mà nó là sợi chỉ đỏ xuyên suốt, kết nối cấu tạo hạt nhân với cấu hình electron, và từ đó định hình toàn bộ tính chất hóa học cũng như vị trí của mỗi nguyên tố trong ngôi nhà chung Bảng tuần hoàn. Nó thực sự là chìa khóa để giải mã thế giới vật chất xung quanh chúng ta.
Đồng vị Những Người Anh Em Cùng Họ Khác Cân
Trong thế giới nguyên tử đầy màu sắc, có một khái niệm khá thú vị gọi là đồng vị. Tưởng tượng xem, cùng là một nguyên tố hóa học đấy, nhưng lại có những "phiên bản" khác nhau một chút. Đồng vị chính là những "anh em" của cùng một nguyên tố, tức là chúng có cùng số hiệu nguyên tử (Z).
Vậy khác nhau ở đâu? À, điểm khác biệt mấu chốt nằm ở số hạt nơtron trong hạt nhân. Đồng vị của cùng một nguyên tố sẽ có số nơtron (N) khác nhau. Nhớ lại công thức tính số khối (A) nhé: A = Z + N. Vì Z giống nhau nhưng N khác nhau, nên hiển nhiên số khối (A) của các đồng vị cũng sẽ khác nhau. Từ công thức này, chúng ta dễ dàng tính được số nơtron bằng cách lấy số khối trừ đi số hiệu nguyên tử: N = A – Z.
Ví dụ điển hình nhất là Hydro. Hydro có Z=1. Nhưng nó có 3 đồng vị chính: Hydro-1 (Protium) có A=1, Hydro-2 (Deuterium) có A=2, và Hydro-3 (Tritium) có A=3. Cùng Z=1, nhưng N khác nhau: H-1 (N=0), H-2 (N=1), H-3 (N=2). Hay Carbon (Z=6) cũng có các đồng vị phổ biến như Carbon-12 (A=12, N=6), Carbon-13 (A=13, N=7), và Carbon-14 (A=14, N=8). Cùng là Carbon, cùng Z=6, nhưng số nơtron lại khác nhau.
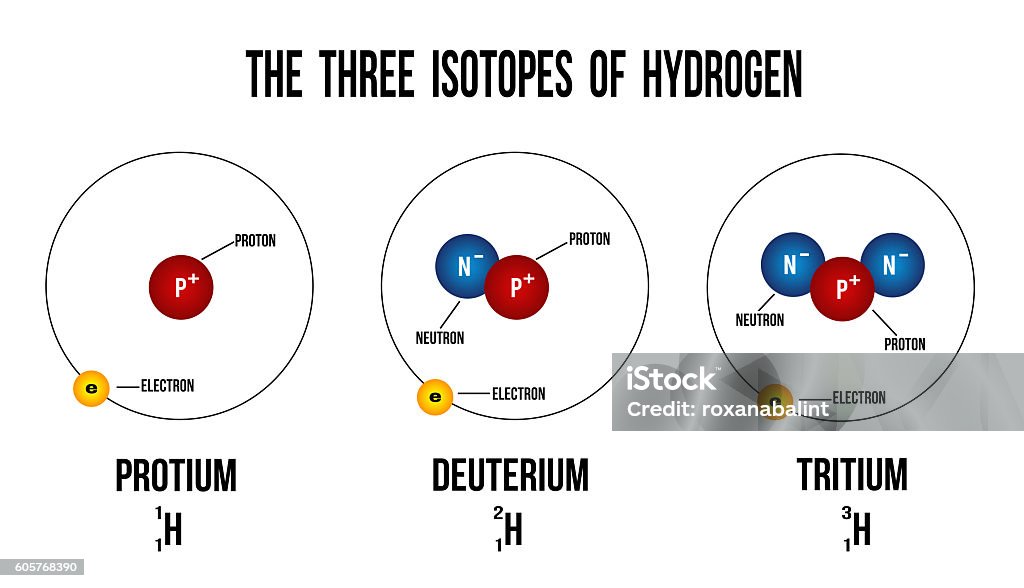
Vậy tại sao khái niệm đồng vị lại quan trọng? Vì số hiệu nguyên tử (Z) quyết định số electron và cấu hình electron của nguyên tử trung hòa, nên các đồng vị của cùng một nguyên tố thường có tính chất hóa học gần như giống hệt nhau. Chúng tham gia phản ứng hóa học theo cách tương tự. Tuy nhiên, do khác nhau về số khối (A), chúng có thể có tính chất vật lý khác nhau một chút, ví dụ như khối lượng riêng hay điểm nóng chảy/sôi. Đặc biệt, một số đồng vị còn có tính chất hạt nhân đặc biệt, như tính phóng xạ (ví dụ Carbon-14, Uranium-235). Hiểu về đồng vị giúp chúng ta giải thích nhiều hiện tượng tự nhiên và ứng dụng chúng trong các lĩnh vực như y học (chẩn đoán, điều trị), khảo cổ học (định tuổi Carbon-14), hay năng lượng hạt nhân.
Hành Trình Lần Tìm Dấu Ấn Nguyên Tố
Ngày xưa, khi các nhà khoa học bắt đầu sắp xếp các nguyên tố hóa học, họ thường dựa vào cái gọi là trọng lượng nguyên tử. Dmitri Mendeleev, với bộ óc thiên tài của mình, đã tạo ra bảng tuần hoàn đầu tiên dựa trên tiêu chí này. Bảng của ông cực kỳ đỉnh, nó không chỉ hệ thống hóa những gì đã biết mà còn để lại chỗ trống cho những nguyên tố chưa được tìm thấy, thậm chí còn dự đoán được tính chất của chúng nữa cơ! Tuy nhiên, đôi khi, việc sắp xếp theo trọng lượng nguyên tử lại gặp chút trục trặc, khiến một vài nguyên tố có vẻ như bị "lệch" khỏi vị trí logic dựa trên tính chất hóa học của chúng. Điều này khiến nhiều người băn khoăn, liệu có thứ gì đó cơ bản hơn trọng lượng nguyên tử đang quyết định vị trí và tính chất của một nguyên tố?
Rồi đến thời kỳ của Ernest Rutherford. Với thí nghiệm bắn phá lá vàng nổi tiếng, ông đã lật ngược hoàn toàn quan niệm về cấu tạo nguyên tử. Thay vì là một "cục đặc" như người ta vẫn nghĩ, nguyên tử hóa ra lại có cấu trúc rỗng, với hầu hết khối lượng tập trung ở một hạt nhân cực nhỏ mang điện tích dương ở trung tâm, còn các electron mang điện tích âm thì quay xung quanh. Khám phá này cực kỳ quan trọng, nó chỉ ra rằng điện tích dương của hạt nhân chính là một đặc tính cốt lõi của nguyên tử.
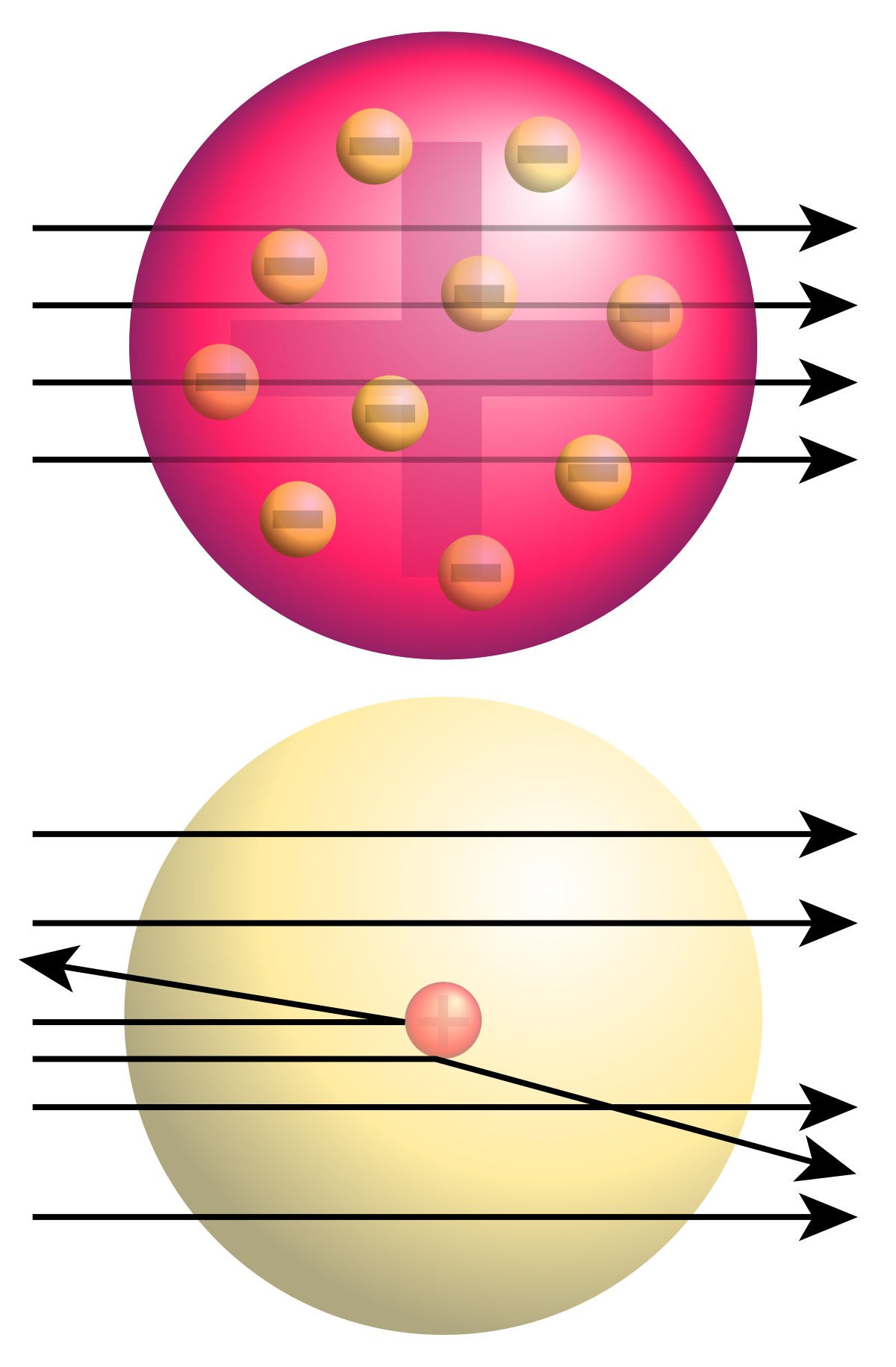
Bước ngoặt thực sự đến từ Henry Moseley, một học trò xuất sắc của Rutherford. Vào khoảng năm 1913, Moseley đã thực hiện một loạt thí nghiệm kinh điển sử dụng tia X. Ông bắn tia X vào các nguyên tố khác nhau và nghiên cứu phổ tia X phát ra. Điều kỳ diệu là ông phát hiện ra một mối quan hệ cực kỳ chặt chẽ giữa tần số của tia X đặc trưng phát ra từ mỗi nguyên tố với vị trí của nguyên tố đó trong bảng tuần hoàn của Mendeleev.
Moseley nhận ra rằng, thứ quyết định vị trí của nguyên tố trong bảng tuần hoàn không phải là trọng lượng nguyên tử một cách tuyệt đối, mà là một con số nguyên tăng dần theo thứ tự các nguyên tố. Ông gọi con số này là số hiệu nguyên tử, và quan trọng hơn, ông chứng minh được rằng con số này chính xác bằng điện tích dương của hạt nhân nguyên tử, và do đó, bằng số proton trong hạt nhân.
Khám phá của Moseley đã giải thích được những "lỗi" nhỏ trong bảng tuần hoàn của Mendeleev và khẳng định rằng số hiệu nguyên tử (Z) mới là đặc tính định danh thực sự của một nguyên tố hóa học, chứ không phải trọng lượng nguyên tử. Từ đó, số hiệu nguyên tử trở thành nền tảng vững chắc cho cấu trúc của bảng tuần hoàn hiện đại và là chìa khóa để hiểu về cấu tạo và tính chất của mọi nguyên tố. Đó là một hành trình dài, từ những sắp xếp ban đầu dựa trên trọng lượng đến việc khám phá ra con số "ma thuật" Z ẩn sâu trong hạt nhân nguyên tử.

