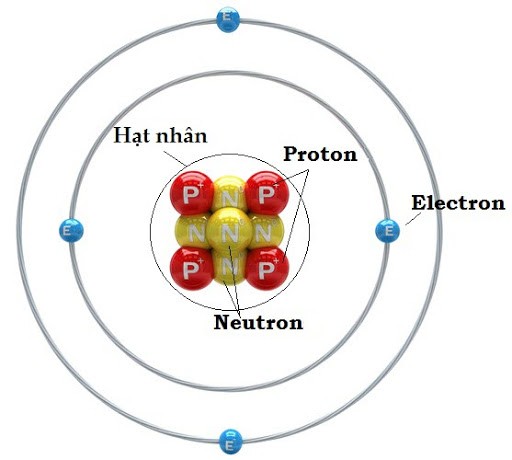
Tưởng tượng nguyên tử như một ngôi nhà siêu nhỏ, và hạt nhân chính là "trái tim" của ngôi nhà ấy. Bên trong "trái tim" bé xíu này chứa đựng những "cư dân" quyết định phần lớn "cân nặng" của ngôi nhà. Một trong những chỉ số quan trọng nhất để "đo đếm" cái "trái tim" này chính là Số khối. Bạn có bao giờ thắc mắc tại sao cùng là nguyên tố Oxy lại có lúc nặng 16, lúc 17, lúc 18 đơn vị chưa? Bí mật nằm ở số khối đấy! Khám phá số khối không chỉ giúp ta hiểu sâu hơn về cấu tạo nguyên tử, mà còn mở ra cánh cửa đến thế giới của đồng vị, năng lượng hạt nhân và vô vàn ứng dụng khác.
Số Khối A Công Thức Tính Nhanh
Nói một cách đơn giản nhất, số khối (ký hiệu là A) chính là tổng số hạt nằm gọn trong cái "hạt nhân" tí hon của nguyên tử. Tưởng tượng hạt nhân như một cái hộp nhỏ, bên trong chứa hai loại "viên bi" chính: đó là proton và neutron. Số khối A chỉ đơn giản là bạn đếm xem có tổng cộng bao nhiêu viên bi trong cái hộp đó mà thôi.
Vậy thì, công thức tính số khối A cực kỳ dễ nhớ:
A = Z + N
Trong đó:
- A là Số khối. Đây là con số nguyên, cho biết tổng số proton và neutron.
- Z là Số hiệu nguyên tử. Con số này bằng đúng số lượng proton trong hạt nhân. Chính số proton này quyết định nguyên tử đó là nguyên tố hóa học gì (ví dụ: 6 proton là Carbon, 8 proton là Oxygen).
- N là số lượng neutron có trong hạt nhân.
Ví dụ, nếu một nguyên tử có 6 proton (Z=6) và 6 neutron (N=6), thì số khối của nó sẽ là A = 6 + 6 = 12. Nguyên tử này chính là một dạng của Carbon, thường được ký hiệu là Carbon-12.
Tóm lại, số khối A không phải là khối lượng thực tế của nguyên tử, mà chỉ là một con số đếm tổng số hạt "nặng" (proton và neutron) trong hạt nhân. Nó cho ta một cái nhìn nhanh về "sức chứa" hạt nhân về mặt số lượng các hạt cơ bản này.
Số khối, Số hiệu và câu chuyện Đồng vị
Khi nói về hạt nhân nguyên tử, có hai con số cực kỳ quan trọng giúp chúng ta "nhận diện" và hiểu về nó: đó là Số hiệu nguyên tử (Z) và Số khối (A). Tưởng chừng đơn giản, nhưng sự kết hợp của hai con số này lại hé mở nhiều điều thú vị về cấu tạo và thậm chí là các "phiên bản" khác nhau của cùng một nguyên tố.
Số hiệu nguyên tử (Z), như chúng ta đã biết, chính là số lượng hạt proton có trong hạt nhân. Con số này duy nhất cho mỗi nguyên tố hóa học. Cứ thấy Z=6 là biết ngay đó là Carbon, Z=8 là Oxygen, không lẫn đi đâu được. Z giống như "chứng minh thư" của nguyên tố vậy.
Còn Số khối (A) thì sao? A là tổng số hạt proton (Z) và hạt neutron (N) trong hạt nhân. Công thức quen thuộc A = Z + N nói lên tất cả. Điều này có nghĩa là, nếu biết số hiệu nguyên tử (số proton) và số khối, ta có thể dễ dàng tính được số lượng hạt neutron: N = A – Z. Như vậy, cặp đôi (Z, A) cho ta biết đầy đủ thành phần hạt nhân: bao nhiêu proton và bao nhiêu neutron.
Vậy, mối liên hệ này dẫn đến câu chuyện về Đồng vị như thế nào? Đồng vị là những nguyên tử của cùng một nguyên tố – nghĩa là chúng có cùng Số hiệu nguyên tử (Z). Chúng vẫn là Carbon (Z=6), vẫn là Oxygen (Z=8), v.v. Tuy nhiên, điểm khác biệt mấu chốt nằm ở số lượng hạt neutron (N) trong hạt nhân của chúng.
Vì Z giống nhau nhưng N khác nhau, theo công thức A = Z + N, thì Số khối (A) của các đồng vị cũng sẽ khác nhau. Chính sự khác biệt về số khối này là dấu hiệu rõ ràng nhất để phân biệt các đồng vị của cùng một nguyên tố.
Ví dụ điển hình là Carbon. Carbon luôn có Z=6. Nhưng trong tự nhiên tồn tại các đồng vị Carbon khác nhau:
- Carbon-12 (¹²C): Có A=12. Vì Z=6, số neutron là N = 12 – 6 = 6.
- Carbon-13 (¹³C): Có A=13. Vì Z=6, số neutron là N = 13 – 6 = 7.
- Carbon-14 (¹⁴C): Có A=14. Vì Z=6, số neutron là N = 14 – 6 = 8.
Cả ba đều là Carbon (Z=6), nhưng số khối (A) khác nhau do số neutron (N) khác nhau. Đây chính là vai trò của số khối trong việc nhận diện và phân loại các đồng vị – những "anh em" cùng họ nhưng khác "cân nặng" trong thế giới nguyên tử.
Số khối và Khối lượng nguyên tử Khác nhau thế nào
Trong thế giới tí hon của nguyên tử, có hai khái niệm mà nhiều người hay nhầm lẫn: Số khối và Khối lượng nguyên tử. Thoạt nghe thì có vẻ chúng nói về cùng một thứ, nhưng thực ra lại có sự khác biệt quan trọng đấy nhé!
Đầu tiên, nói về Số khối, ký hiệu là A. Cái tên nói lên tất cả – nó đơn giản là tổng số hạt "nặng" trong hạt nhân nguyên tử, tức là tổng số proton và neutron. Hãy tưởng tượng hạt nhân như một cái hộp, số khối chỉ cho bạn biết có bao nhiêu viên bi (proton và neutron) ở trong đó. Vì là số lượng hạt, nên số khối luôn là một số nguyên dương. Nó giống như việc đếm số người trong một căn phòng vậy, không thể có nửa người được đúng không nào?
Còn Khối lượng nguyên tử thì lại khác. Đây là khối lượng thực tế của một nguyên tử hoặc một đồng vị cụ thể, thường được đo bằng đơn vị khối lượng nguyên tử thống nhất (amu hoặc u). Nếu số khối chỉ là "số đếm", thì khối lượng nguyên tử là "cân nặng" thật sự. Và cái cân nặng này thường là một số thập phân, chứ không phải lúc nào cũng là số nguyên.
Vậy tại sao lại có sự khác biệt này, khi mà proton và neutron đều có khối lượng xấp xỉ 1 amu? Lý do nằm ở hai điểm chính:
- Khối lượng proton và neutron không chính xác bằng 1 amu: Đơn vị amu được định nghĩa dựa trên nguyên tử Carbon-12 (có số khối là 12 và khối lượng nguyên tử chính xác là 12 amu). Khối lượng của một proton tự do và một neutron tự do khi đứng riêng lẻ không hoàn toàn bằng 1 amu, mà hơi khác một chút.
- Năng lượng liên kết hạt nhân (Binding Energy): Đây là yếu tố quan trọng nhất tạo nên sự khác biệt. Khi các proton và neutron kết hợp lại với nhau để tạo thành hạt nhân, một phần rất nhỏ khối lượng của chúng sẽ "biến" thành năng lượng để giữ các hạt này lại với nhau (theo công thức nổi tiếng E=mc² của Einstein). Hiện tượng này gọi là "hụt khối" (mass defect). Chính cái phần khối lượng bị "hụt" đi này làm cho khối lượng thực tế của hạt nhân (và do đó là nguyên tử) hơi khác so với tổng khối lượng của các proton và neutron khi chúng đứng riêng lẻ.
Vì vậy, số khối (A) chỉ là một con số nguyên cho biết tổng số hạt trong hạt nhân, còn khối lượng nguyên tử là khối lượng thực tế của nguyên tử đó, bị ảnh hưởng bởi khối lượng riêng lẻ của các hạt và năng lượng liên kết hạt nhân. Số khối cho ta một con số ước chừng về khối lượng, còn khối lượng nguyên tử mới là con số chính xác hơn về "cân nặng" của nguyên tử.

Số khối: Chìa khóa khám phá thế giới hạt nhân
Số khối (A) không chỉ là một con số đơn thuần. Nó là "chứng minh thư" của hạt nhân, cho ta biết tổng số hạt cấu thành nên nó – tức là tổng số proton và neutron. Chính con số này mở ra cánh cửa hiểu biết sâu sắc về thế giới tí hon, đầy bí ẩn bên trong nguyên tử và ứng dụng nó vào đời sống.
Sao biết một hạt nhân có "yên ổn" hay không? Số khối đóng vai trò quan trọng đấy. Khi kết hợp với số hiệu nguyên tử (Z), ta biết được số neutron (N = A – Z). Tỷ lệ giữa neutron và proton (N/Z) là yếu tố then chốt quyết định hạt nhân đó bền hay dễ bị phân rã phóng xạ. Số khối giúp các nhà khoa học dự đoán "số phận" của nguyên tử, liệu nó có tồn tại lâu dài hay sẽ biến đổi thành nguyên tố khác.
Trong vật lý hạt nhân, số khối là thông số cơ bản để phân loại và nghiên cứu các hạt nhân. Nó giúp ta hiểu về lực hạt nhân, cách các hạt sắp xếp bên trong, và dự đoán kết quả của các va chạm hạt nhân. Mỗi phản ứng hạt nhân đều phải tuân thủ định luật bảo toàn số khối (trong nhiều trường hợp), nên việc theo dõi A là cực kỳ quan trọng để cân bằng phương trình và phân tích quá trình.
Hóa học đồng vị "sống" dựa vào sự khác biệt về số khối. Các đồng vị của cùng một nguyên tố có tính chất hóa học gần như nhau, nhưng khối lượng khác nhau (do A khác nhau). Sự khác biệt nhỏ này cho phép ta tách đồng vị, dùng chúng làm chất đánh dấu (tracer) trong y học (chẩn đoán, điều trị ung thư), nghiên cứu môi trường, hay xác định tuổi cổ vật (như dùng Carbon-14 với A=14). Số khối giúp phân biệt "anh em" đồng vị này, mở ra vô vàn ứng dụng thực tế.
Ngay cả trong các kỹ thuật phân tích hiện đại, số khối cũng là nền tảng. Phổ khối (Mass Spectrometry) là một ví dụ điển hình. Kỹ thuật này phân tách các ion dựa trên tỷ lệ khối lượng trên điện tích của chúng. Vì khối lượng của nguyên tử/phân tử chủ yếu được quyết định bởi số khối của các hạt nhân cấu thành, phổ khối giúp xác định thành phần nguyên tố và đồng vị của mẫu vật một cách chính xác, ứng dụng rộng rãi từ pháp y đến kiểm định chất lượng thực phẩm.
Tóm lại, từ việc dự đoán sự "ổn định" của một nguyên tử đến việc ứng dụng trong y tế hay khảo cổ, số khối là một đại lượng không thể thiếu, là nền tảng cho nhiều khám phá và công nghệ tiên tiến trong khoa học.
Số khối nhảy múa khi hạt nhân biến hình
Hạt nhân nguyên tử không phải lúc nào cũng đứng yên đâu nhé. Đôi khi, chúng trải qua những cuộc "biến hình" ngoạn mục, hay còn gọi là các quá trình biến đổi hạt nhân. Lúc này, thành phần bên trong hạt nhân thay đổi, và tất nhiên, số khối (A) của nó cũng sẽ thay đổi theo.
Nhớ lại, số khối A là tổng số hạt proton (Z) và neutron (N) trong hạt nhân (A = Z + N). Vì vậy, bất cứ khi nào số lượng proton hay neutron thay đổi, số khối cũng sẽ thay đổi tương ứng.
Một ví dụ điển hình là quá trình phân rã alpha. Đây là kiểu "biến hình" mà hạt nhân nguyên tử nặng phát ra một hạt alpha. Hạt alpha thực chất là hạt nhân của nguyên tử Helium, gồm 2 proton và 2 neutron. Khi một hạt nhân "nhả" ra hạt alpha, nó mất đi 2 proton và 2 neutron. Điều này có nghĩa là số hiệu nguyên tử (Z) giảm đi 2, và số neutron (N) cũng giảm đi 2. Kết quả là, số khối (A = Z + N) của hạt nhân ban đầu sẽ giảm đi 4 đơn vị.
Ví dụ, nguyên tử Uranium-238 (có A = 238) khi phân rã alpha sẽ biến thành Thorium-234 (có A = 234). Số khối đã giảm từ 238 xuống 234, đúng bằng 4 đơn vị của hạt alpha bị mất đi.
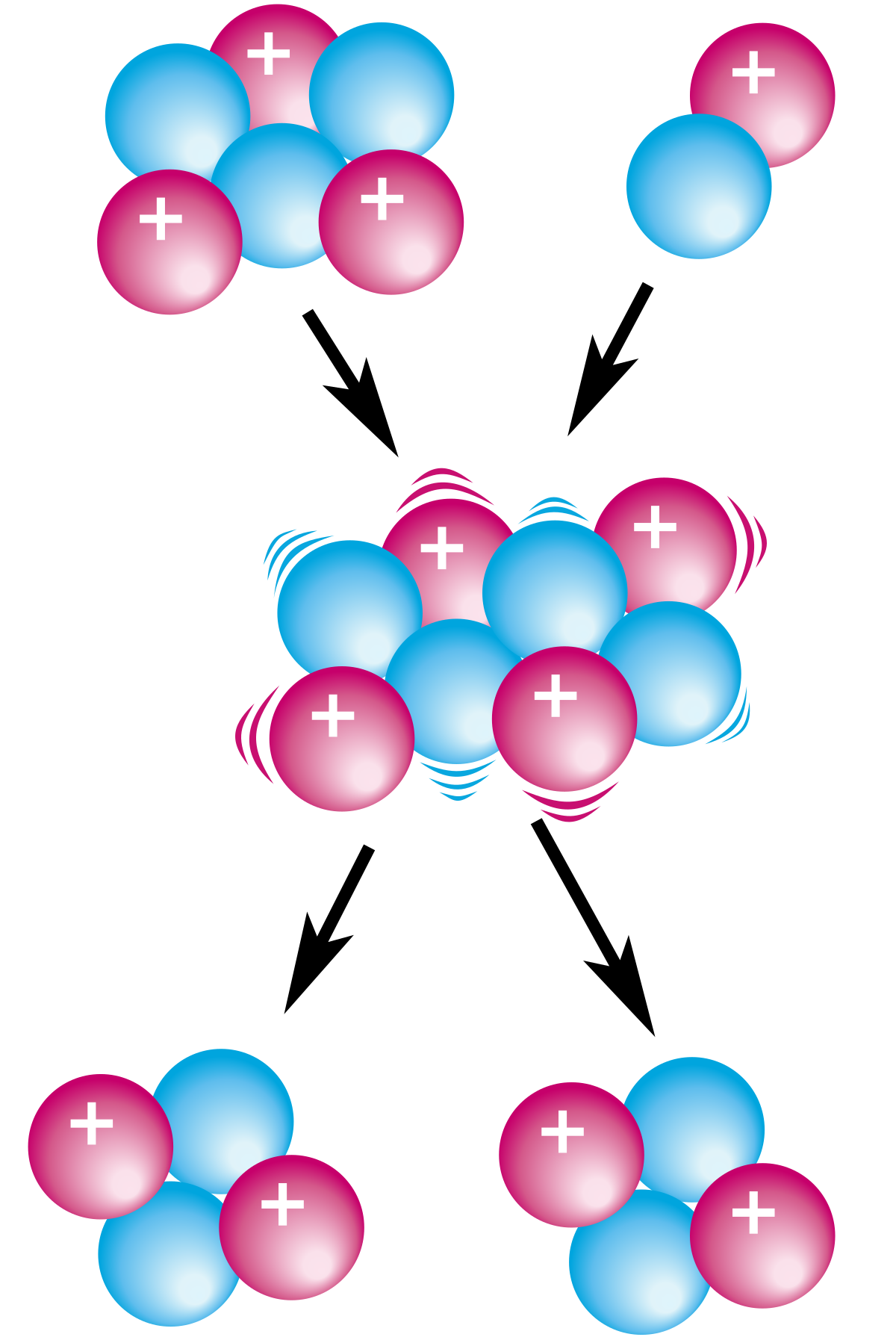
Ngoài phân rã alpha, các quá trình biến đổi hạt nhân khác như phân hạch (hạt nhân nặng tách thành hạt nhân nhẹ hơn) hay tổng hợp hạt nhân (hạt nhân nhẹ kết hợp thành hạt nhân nặng hơn) cũng làm thay đổi số lượng proton và neutron, dẫn đến sự thay đổi rõ rệt của số khối.
Việc theo dõi sự thay đổi của số khối trong các phản ứng hạt nhân cực kỳ quan trọng. Nó giúp các nhà khoa học hiểu được "chuyện gì đang xảy ra" bên trong hạt nhân và cân bằng các phương trình phản ứng hạt nhân, giống như việc cân bằng phương trình hóa học vậy đó!
